
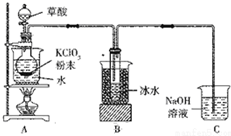
 二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示:
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示:分析 (1)二氧化氯(ClO2)沸点为11℃,用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,装置A必须添加温度控制装置;ClO2的沸点低,用冰水可以使ClO2冷凝为液体;
(2)KClO3和草酸发生氧化还原反应生成ClO2、K2CO3、CO2和H2O;
(3)①根据ClO2在碱溶液中发生岐化其氧化产物和还原产物的物质的量比为1:1,可知Cl的化合物由+4变为+3和+5,还原产物为NaClO2,氧化产物为NaClO3;
②NaClO2溶液中制得NaClO2晶体的操作步骤:蒸发结晶、趁热过滤;
(4)H2O2作还原剂时氧化产物为O2,不会产生环境污染.
解答 解:(1)二氧化氯(ClO2)沸点为11℃,用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,装置A必须添加温度控制装置,故装置A中还应安装的玻璃仪器是温度计;装置B用冰水浴的原因是ClO2的沸点:11.0℃,沸点低,用冰水可以使ClO2冷凝为液体,收集在试管中或常温下二氧化氯为气态
故答案为:温度计;常温下二氧化氯为气态;
(2)KClO3和草酸发生氧化还原反应生成ClO2、K2CO3、CO2和H2O,反应的化学方程式为2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O,
故答案为:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;
(3)①根据ClO2在碱溶液中发生岐化其氧化产物和还原产物的物质的量比为1:1,可知Cl的化合物由+4变为+3和+5,还原产物为NaClO2,氧化产物为NaClO3,
因此化学方程式为:2ClO2+2OH-=ClO2-+ClO3-+H2O,
故答案为:2ClO2+2OH-=ClO2-+ClO3-+H2O;
②NaClO2溶液中制得NaClO2晶体的操作步骤:蒸发结晶、趁热过滤、洗涤、干燥,
故答案为:蒸发结晶; 趁热过滤;
(4)还可采用盐酸或双氧水还原氯酸钠制备ClO2.用H2O2作还原剂制备ClO2更受欢迎,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2,不会产生环境污染,
故答案为:H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2,污染环境.
点评 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(l);|△H|>297.3kJ/mol | |
| B. | S(g)+O2(g)=SO2(l);|△H|<297.3kJ/mol | |
| C. | 1mol SO2的键能总和小于1mol S和1mol O2键能之和 | |
| D. | 1mol SO2的具有的能量等于1mol S和1mol O2具有的能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
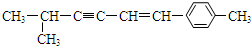 ,下列说法中正确的是( )
,下列说法中正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能共面的碳原子数最多为13个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
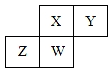 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | ZY2晶体熔化、液态Y3气化均需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
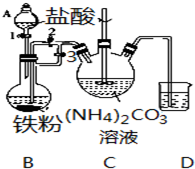 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
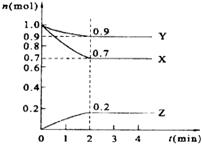 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com