
【题目】中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
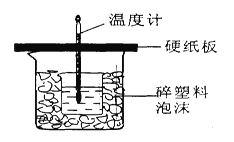
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_____ _______。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值___________(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,
与上述实验相比,所放出的热量____________(填“相等”或“不相等”),所求中和热的数值会____________(填“相等”或“不相等”),理由是_____________________________。
【答案】(1)环形玻璃搅拌棒或环形玻璃棒;保温、隔热,减少实验过程中的热量损失(2)偏小(3)不相等;相等;中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量,与酸、碱的用量无关
【解析】
试题分析::(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,减少实验过程中的热量损失;(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;(3)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏大,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行上述实验,测得中和热数值相等,故答案为:不相等;因为酸、碱发生中和反应放出的热量与酸、碱的用量有关;相等;中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量,它与酸、碱的用量无关.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】500oC下,在2L体积固定的密闭容器中发生反应:2A(g)![]() 2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
(1)计算500oC时该反应的化学平衡常数?
(2)平衡时A的转化率是多少?
(3)设温度不变,反应前容器内压强为p0,则反应达平衡时,容器内压强是多少?(用p0表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制500 mL 0.2 mol/LNaOH溶液需要的NaOH质量是多少?
(2)取上述溶液20 mL稀释成100 mL后其物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图装置及药品进行酸性强弱的实验,下列说法不正确的是
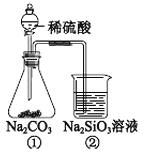
A. ①和②中发生的反应均为复分解反应
B. 若将实验中的稀硫酸换成稀盐酸也能比较三种酸强弱
C. 一段时间后②中有胶冻状物质生成
D. 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成尿素的第一步反应在高温、高压、超临界态的二氧化碳与氨反应生成甲胺,在2 L的密闭容器中发生反应:CO2 (g) + 2NH3 (g)![]() NH4COONH2 (g) ΔH=" -117.2" KJ/mol 。下列措施能提高NH3转化率的是( )
NH4COONH2 (g) ΔH=" -117.2" KJ/mol 。下列措施能提高NH3转化率的是( )
A. 升高温度 B. 通入过量的CO2
C. 通入过量的NH3 D. 使用高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴的“空气吹出法”是先用氯气将溴离子转化为溴单质,然后通入热空气和水蒸气将溴吹出。将溴吹出的方法利用了溴单质的
A. 氧化性 B. 还原性 C. 挥发性 D. 腐蚀性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
(1)步骤Ⅰ中所用的试剂是______________。
(2)步骤Ⅲ中反应的离子方程式是_________________。
(3)步骤Ⅴ可选用的试剂是__________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤Ⅵ的实验操作是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂,用最简单的方法鉴别下列物质:
①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,正确的鉴别顺序是
A. ①②③④ B. ③④②① C. ④①②③ D. ③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为短周期元素的一部分,请参照元素①~⑧在表中的位置,回答下列问题。
① | ||||||
② | ③ | ④ | ||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)元素⑦在元素周期表位置是________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)。________________________
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)_______________。
(4)由①和④组成的元素质重比为1:8的化合物的电子式是_________。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为。______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com