
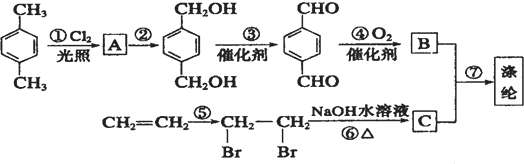
 ,可知A的结构简式为
,可知A的结构简式为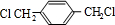 ,
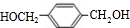
, 在Cu或Ag作催化剂条件下,发生催化氧化生成
在Cu或Ag作催化剂条件下,发生催化氧化生成 ,
, 发生氧化反应生成B为
发生氧化反应生成B为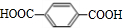 .乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br发生水解反应生成C为HOCH2CH2OH,对苯二甲酸与乙二醇发生缩聚反应得到涤纶为
.乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br发生水解反应生成C为HOCH2CH2OH,对苯二甲酸与乙二醇发生缩聚反应得到涤纶为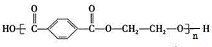 ,据此解答.
,据此解答. ,可知A的结构简式为
,可知A的结构简式为 ,
, 在Cu或Ag作催化剂条件下,发生催化氧化生成
在Cu或Ag作催化剂条件下,发生催化氧化生成 ,
, 发生氧化反应生成B为
发生氧化反应生成B为 .乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br发生水解反应生成C为HOCH2CH2OH,对苯二甲酸与乙二醇发生缩聚反应得到涤纶为
.乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br发生水解反应生成C为HOCH2CH2OH,对苯二甲酸与乙二醇发生缩聚反应得到涤纶为 ,
, ,C为HOCH2CH2OH,
,C为HOCH2CH2OH, ;HOCH2CH2OH;
;HOCH2CH2OH; ,
, .
.


 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
| A、NaOH稀溶液分别与稀盐酸和稀醋酸反应生成1 mol H2O,放出热量相同 |
| B、稀盐酸分别与NaOH稀溶液和稀氨水反应生成1 mol H2O,放出热量相同 |
| C、Ba(OH)2稀溶液分别与稀盐酸和稀硫酸反应生成1 mol H2O,放出热量不同 |
| D、该反应说明有水生成的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+ |
| B、在pH=12的溶液中:NH4+、K+、ClO-、Cl- |
| C、有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| D、在碳酸氢钠的溶液中:K+、SO42-、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3-n |
| 2 |
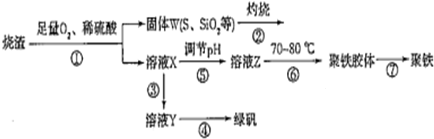
| ||
| 3-n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
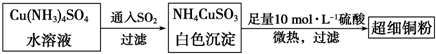
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.05×10-4mol?L-1 |
| B、5.56×10-3mol?L-1 |
| C、1.01×10-4mol?L-1 |
| D、1.01×10-3mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com