
【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置__________________。
(2)化合物乙的电子式为_____________,用电子式表示形成化合物丁的过程_____ 。
(3)写出丙与甲反应的离子方程式:___________________。
(4)固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许O2–在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。该电池的负极为____(填a或b);O2–流向____极(填“正”或“负”);该电池的正极反应式为 _____。

【答案】(1)第三周期第ⅦA族 (2)![]()
![]()
(3)2Na2O2+2H2O=4Na++4OH-+O2↑ (4)b 负 O2+4e-=2O2-
【解析】试题分析:原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多2,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A是周期表中半径最小的元素,则A为H元素;C的最外层电子数是内层电子的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;C与E同主族,则E为S元素;A与D同主族,D的原子序数大于氧,故D为Na;F的原子序数最大,且F元素是同周期元素中原子半径最小的主族元素,故F为Cl,可推知甲为H2O、乙为H2O2、丙为Na2O2、丁为Na2S。
(1)元素F为Cl,在周期表中的位置为第三周期第ⅦA族;
(2)乙为H2O2,属于共价化合物,电子式为![]() ;硫化钠是离子化合物,用电子式表示形成化合物Na2S的过程为
;硫化钠是离子化合物,用电子式表示形成化合物Na2S的过程为![]() ;
;
(3)丙与甲反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体O2、H2的载体。负极发生氧化反应,氢气在负极失去电子,该电池的负极为b,O2-流向负极,正极发生还原反应,氧气在正极获得电子生成氧离子,该电池的正极反应式为O2+4e-=2O2-。


科目:高中化学 来源: 题型:
【题目】A是常见的有机物质,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平。有关物质的转化关系如图所示,请回答下列问题:

(1)B的结构式为 。D的物质的名称是 。
(2)在①~④反应中,属于加成反应的是 (填反应序号)。
(3)写出下列反应的化学方程式:
反应① ;反应② ;反应③ 。
(4)实验室用下图所示装置进行反应④。

A.反应④的化学方程式是 。
B.试管乙中应加入 ,乙中的导管不能伸入到液面下的原因是 。
C.实验完成后,从试管乙中分离出有机物C的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是短周期三种元素,它们在周期表中的位置如图所示。试回答:
X | ||
Y | ||
Z |
(1)X元素单质的化学式是__________________________________。
(2)Z元素的原子结构示意图为________________________________。
(3)Y在元素周期表中的位置是______________________。
(4)与Z同主族的下一周期元素的原子序数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
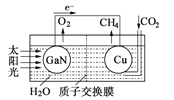
(1)科学家用氮化镓材料与铜组装如右图的人工光合系统, 利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
①该反应的平衡常数表达式为 。
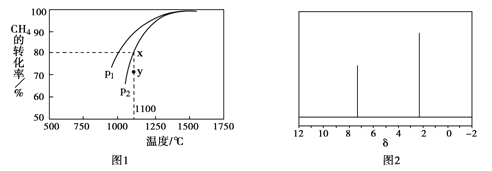
②在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“>”或“<”);压强为P2时,在Y点:v(正) v(逆)(填“>”、“<”或“=”)。
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如下图2,则X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列说法不正确的是( )
A.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A.回收其中的石墨电极
B.利用电池外壳的金属材料
C.防止电池中汞、镉和铅等重金属离子对土壤和水资源的污染
D.不使电池中渗泄的电解质腐蚀其他物品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行了如下实验。
【分子式的确定】
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况)。则该有机物中各元素的原子个数比是 。
(2)该有机化合物的相对分子质量为46,则其分子式是 。
(3)预测A的可能结构并写出结构简式 。
【结构简式的确定】
(4)经测定,在标准状况下0.2mol有机物A与足量金属钠反应生成2.24L的氢气,则A的结构简式为 。理由__________________。
【性质实验】
(5)A在一定条件下脱水可生成B,用B制备氯乙烷原子利用率为100%,请写出上述由B制备氯乙烷反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,不正确的是
A.FeSO4 可用于防止食品氧化变质,延长食品的保质期
B.向Fe2(SO4)3 溶液中加入一定量的铜粉,铜粉全部反应后,溶液中一定含有Fe2+
C.物质NaHCO3、Al2O3、Fe2O3、Al(OH)3、Al 都既能跟盐酸反应, 又能跟氢氧化钠溶液反应
D.铁在氧气中燃烧,生成黑色的Fe3O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com