
 2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。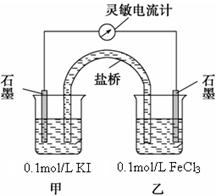
 2Fe2+ + I2平衡朝逆反应方向移动 (2分)
2Fe2+ + I2平衡朝逆反应方向移动 (2分) 2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。

科目:高中化学 来源:不详 题型:单选题
 pC (g)+q(g);△H<0。下列结论中不正确的是( )
pC (g)+q(g);△H<0。下列结论中不正确的是( ) 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
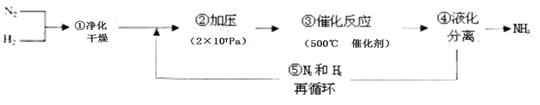
| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
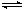 2Z(g) 此反应达到平衡的标志是( )
2Z(g) 此反应达到平衡的标志是( )| A.正反应和逆反应的速率都为零 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1∶2∶2 |
| D.单位时间消耗0.1molX同时生成0.2molZ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 PCl3(g)+Cl2 (g)充分反应平衡后,测得PCl5的分解率为a%, 此时,再向密闭容器中加入1mol PCl5 ,充分反应,再次平衡后,下列有关说法正确的是( )
PCl3(g)+Cl2 (g)充分反应平衡后,测得PCl5的分解率为a%, 此时,再向密闭容器中加入1mol PCl5 ,充分反应,再次平衡后,下列有关说法正确的是( )| A.PCl5的分解率大于a% |
| B.PCl5的分解率小于a% |
| C.达到平衡后正逆反应速率比原平衡状态时大 |
| D.达到平衡后正逆反应速率比原平衡状态时小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸工业中SO2转化为SO3时采用常压,是因为增大压强不会提高SO2的转化率。 |
| B.打开啤酒瓶的瓶盖,大量的气泡冒出来,该现象不能用勒夏特列原理解释。 |
| C.氯碱工业:用离子交换膜电解槽电解时,往阳极室注入经过精制的 NaCl溶液,往阴极室注入稀氢氧化钠溶液(或去离子水)。 |
| D.工业上合成氨采用500℃左右的温度,其原因是适当加快NH3的合成速率,催化剂在500℃左右时其活性最好,且能提高H2的转化率。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
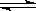 C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是 ( )
C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是 ( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.平衡时,体系内含NO2为0.04mol·L-1 |
| B.平衡时,N2O4的转化率为60% |
| C.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1 |
| D.在2s时,体系内压强为反应前的1.1倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
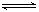 2B(g)和2C(g)
2B(g)和2C(g) 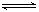 D(g),X1和X2分别是A和C的转化率。在温度不变时,均增加相同的A和C的物质的量,下列判断正确的是
D(g),X1和X2分别是A和C的转化率。在温度不变时,均增加相同的A和C的物质的量,下列判断正确的是| A.X1降低,X2增大 | B.X1、X2均降低 |
| C.X1增大,X2降低 | D.X1、X2均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com