
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 与铝反应产生氢气的溶液中:Na+、NH4+、SO42-、CH3C00- | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:NH4+、Cl-、AlO2-、SO42- | |
| C. | 使甲基橙变红的溶液中:K+、Al3+、SO42-、NO3- | |
| D. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-a}{b}$ | B. | $\frac{2(b-a)}{b}$ | C. | $\frac{3a-2b}{b}$ | D. | $\frac{2b-3a}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
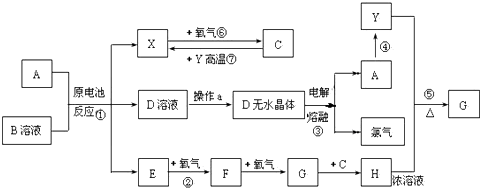
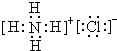
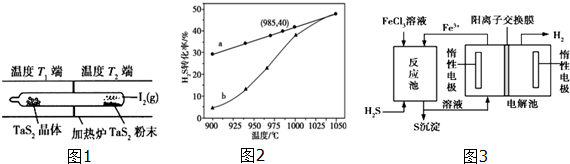
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
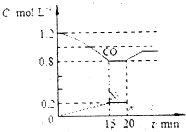 CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40Wg | B. | 80ng | C. | 5(m-n)g | D. | mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com