
【题目】用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向溶液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是:_____________________________________。
(2)将MnO4-氧化Fe2+的的离子方程式补充完整:_____
![]()
(3)己知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注意:金属离子的起始浓度为0.1mol·L-1。
根据表中数据解释步骤Ⅱ的目的_______________________________。
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是_______________。
②Ⅳ中加入MnSO4的目的是_______________________________________。
【答案】 Al2O3+6H+=2Al3++3H2O 5 8 H+ 5 4 H2O pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀 生成黄绿色气体 除去过1的MnO4-
【解析】(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;(2)高锰酸根离子在酸溶液中被还原为锰离子,亚铁离子被氧化为铁离子,反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,故答案为:1、5;8H+;1、5;4H2O;(3)向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,铁离子开始沉淀和沉淀完全的溶液pH为1.5--2.8,铝离子和亚铁离子开始沉淀的溶液pH大于3,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;(4)一定条件下,MnO4-可与Mn2+反应生成MnO2,①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体;②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去;


科目:高中化学 来源: 题型:
【题目】夹紧下列装置中的弹簧夹并进行相关操作。下列情形中,表明相应装置漏气的是( )

A. 装置①中,用手捂住试管,烧杯中出现气泡,放开手后,导管中形成一段稳定的水柱
B. 装置②中,向长颈漏斗中加入一定量水,形成水柱,随后水柱下降至与瓶中液面相平的位置
C. 装置③中,双手捂住烧瓶,导管中形成一段稳定的水柱,双手放开后,水柱慢慢回落
D. 装置④中,将a管向上提至一段高度,a、b两管之间水面形成稳定的高度差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
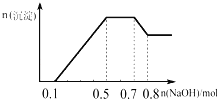
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中一定不含CO32﹣,一定含有SO42﹣和NO3﹣
C. 溶液中n(NH4+)=0.2 mol
D. 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2molMnO2和50ml 12mol/L盐酸混合后充分加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑盐酸的挥发) ( )
A、等于0.3mol B、小于0.3mol C、大于0.3mol,小于0.6mol D、等于0.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
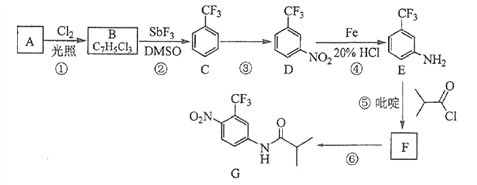
回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a为在恒温恒容密闭容器中分别充入X、Y、Z三种气体,一定条件下发生反应,各物质浓度随时间的变化。若从t2开始,每个时刻只改变一个且不同的条件,物质Z 的正、逆反应速率随时间变化如图b。下列说法不正确的是( )
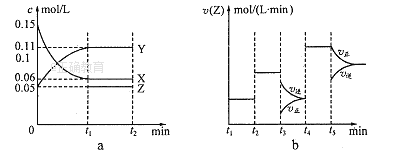
A. 0~t1min内X与Y的平均反应速率之比为3:2
B. t2时刻改变的条件可能是压强或催化剂
C. 该反应的正反应为放热反应
D. 该反应中Z一定为产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是实验室常用的部分仪器,请回答下列问题

(1)序号为⑩的仪器的名称为______________;
(2)能作反应容器且可直接加热的仪器是上述中的___________(填名称);
(3)仪器上标有温度的是_________(填序号);
(4)若用CCl4 提取碘水中的碘,必须用到上述仪器中的_________(填序号),试描述静置后的现象_____________________________________________;
(5)甲同学想用如下图装置,以大理石和稀盐酸反应制取CO2。老师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上述①~⑩中的一种仪器,加在装置上,解决了这个问题。丙同学采用的方法是___________________________;
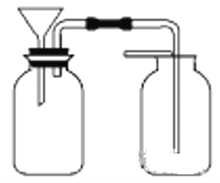
(6)乙同学也想制取CO2气体,而实验室只有H2SO4、浓HNO3、水、块状纯碱、块状石灰石,比较合理的方案应选用的药品是__________________________________;
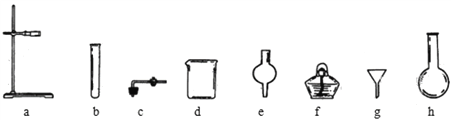
(7)丙同学在没有现成的CO2气体发生器的情况下,选用下图中的部分仪器,装配成一个简易的、能随用随停的CO2气体发生器,应选用的仪器是________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如下图所示:
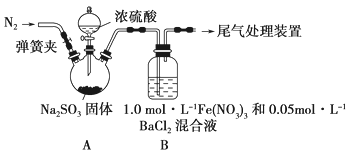
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答下列问题:
(1)装置A中反应的化学方程式是______________________________________
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______________________________________________________
(3)装置B中产生了白色沉淀,其成分是 _________ ,说明SO2具有_______ 性。
(4)分析B中产生白色沉淀的原因:
猜想1:_____________________________________________________________;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3—反应;
①按猜想2,装置B中反应的离子方程式是 _____________________________________。
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是 ________(填字母)。
a.0.1 mol·L-1硝酸钠溶液 b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com