
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ;
(2)已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1,利用盖斯定律将$\frac{①+②}{2}$可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-$\frac{574+1160}{2}$kJ•mol-1=867kJ•mol-1,以此解答该题;
解答 解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热为22.68kJ×32=725.8KJ,所以甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1;
(2)由(1)得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-$\frac{574+1160}{2}$kJ•mol-1=867kJ•mol-1,n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol×8NA=1.6NA=9.6×1023,放出的热量为0.2×867=173.4kJ,
故答案为:9.6×1023或1.6NA;173.4.
点评 本题考查反应热以及氧化还原反应的计算,侧重于学生的计算能力和分析能力的考查,注意盖斯定律的应用,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到该元素的单质 | |
| C. | H2O2既有氧化性又有还原性 | |
| D. | 分解反应和置换反应均属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物属于醛类 | |
| B. | 燃烧该有机物4.4 g,生成1.8g水 | |
| C. | 1 mol该有机物一定条件下能与l mol H2加成 | |
| D. | 0.01 mol该有机物与足量银氨溶液充分反应,析出金属银2.16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
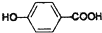
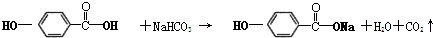 ,
,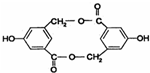 ,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.
,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.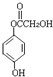 等(只写一种).
等(只写一种).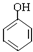 .
.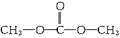 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +HNO3(浓)$→_{55℃}^{浓硫酸}$
+HNO3(浓)$→_{55℃}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
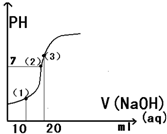 常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )
常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )| A. | 点(1)所示溶液中:C(CH3COOH)+C(H+)=C(CH3COO-)+C(OH-) | |
| B. | 点(2)所示溶液中:C(Na+)=C(CH3COO H )+C(CH3COO-) | |
| C. | 点(3)所示溶液中:C(Na+)>C(OH-)>C(CH3COO-)>C(H+) | |
| D. | 滴定过程中可能出现:C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
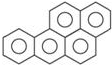 苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )
苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )| A. | 10,30 | B. | 10,32 | C. | 11,30 | D. | 11,32 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
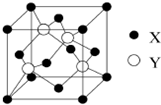 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com