
化学反应N2+3H2===2NH3的能量变化如图所示(假设该反应反应完全)
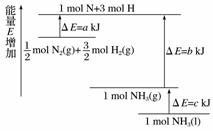
试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式。
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,已知X的最高价氧化物对应的水化物化学式为H2XO3,Z的基态原子最外层电子排布式为3s23p1,W的一种核素的质量数为28,中子数为14。
则:(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)Z的第一电离能比W的________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,x越大,其原子吸引电子的能力越强。下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)通过分析x值变化规律,确定Mg的x值范围:____<x(Mg)<________。
(2)推测x值与原子半径的关系是________________________________________;
根据短周期元素的x值变化特点,体现了元素性质的________________变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:HClO________,HFO________。
(4)经验规律告诉我们:成键的两原子相应元素x数值的差值为Δx,当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位于第________周期第________族(放射性元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.CO2、甲烷都属于温室气体
B.用甘蔗生产的燃料乙醇属可再生能源,利用乙醇燃料不会产生温室气体
C.太阳能、风能和生物质能属于新能源
D.太阳能电池可将太阳能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为__________________,A与B在原子的电子层结构上的相同点是________________________________________________________________________
________________________________________________________________________。
(2)易与C发生化学反应的酸是________(写名称),反应的化学方程式是________________________________________________________________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:___________________________________。
②要将纯碱高温熔化,下列坩埚中可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com