
一个完整的氧化——还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式.如
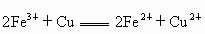 可以写成;氧化反应
可以写成;氧化反应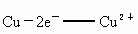 ;还原反应
;还原反应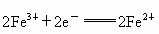
(1)根据以上信息将反应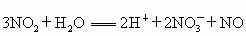 拆分为两个“半反应式”,氧化反应:_______________;还原反应:____________.
拆分为两个“半反应式”,氧化反应:_______________;还原反应:____________.
(2)已知某一反应的两个半反应式为
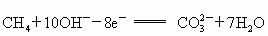 ;
;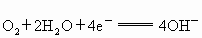 则总反应为_____________________.
则总反应为_____________________.
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源:2010-2011学年浙江省杭州萧山三校高三上学期期中联考化学试卷 题型:填空题
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 ▲ > ▲ > ▲ 。
(2)铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是 ▲
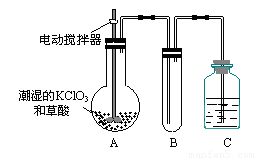
(3)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置 ▲ ;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是 ▲ _(填“A、B或C”),理由是 ▲
③C中应装的试剂为 ▲ 。
C中发生反应的离子方程式为: ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把图b中的物质补充到图a中,可得到一个完整的氧化还原型离子方程式(未配平).对该氧化还原型离子方程式说法不正确的是

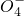 作氧化剂
作氧化剂查看答案和解析>>
科目:高中化学 来源:上海模拟题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com