
【题目】下列关于有机物性质的叙述错误的是
A.甲烷和氯气在光照条件下反应产生油状液滴
B.乙烯能使溴的四氯化碳溶液褪色
C.苯能使酸性高锰酸钾溶液褪色
D.乙醇可以和金属钠反应放出氢气
科目:高中化学 来源: 题型:
【题目】硅胶和石英的主要成分都是SiO2,前者是结构疏松的SiO2,后者是结构致密的SiO2。二者成分相同,结构不同,化学性质相同,物理性质上表现出差别,具有不同的用途。由石英制取硅胶,经历以下三步,试写出每步反应的化学方程式(是离子反应的,写出离子方程式)。
(1)用NaOH溶液溶解石英:______________。
(2)__________,加入盐酸,至沉淀不再产生:______________。
(3)微热,浓缩硅酸溶液,加热蒸干溶液,并使固体完全分解:_____________。写出硅胶的一种用途:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
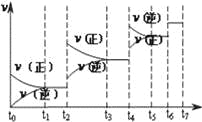
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18molL﹣1min﹣1,则N2消耗速率为v(N2)= ;
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法不正确的是( )
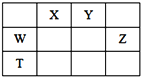
A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中有共价键
C. 物质WY2、W3X4均有熔点高、硬度大的特性
D. T元素肯定是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.因SiO2不溶于水,故H2SiO3不是SiO2对应的酸或者SiO2不是H2SiO3的酸酐
B.CO2通入水玻璃,可以得到硅酸沉淀
C.SiO2是一种空间立体网状结构的晶体,熔点高,硬度大
D.氢氟酸能够腐蚀玻璃,故不能用玻璃瓶来装氢氟酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学用右图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
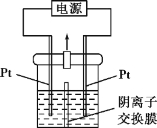
已知:3I2+6OH-= IO3-+5I-+3H2O
回答下列问题:
(1)左侧为电源__________极。(填“正”或“负”)
(2)请用方程式及必要的文字解释左侧溶液变蓝色的原因?___________________。
(3)写出右侧发生的有关电极反应的反应式:_____________________。
(4)电解反应结束时,左侧溶液中还_________I-。(填“有”或“没有”)
(5)写出电解槽内发生反应的总化学方程式:_____________________。
(6)如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应_________。(填“变”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用洗净的废铜屑作原料来制备硝酸铜.下列设计路线符合“绿色化学”思想的是( )
A.Cu+HNO3(浓)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关过滤和蒸发的操作中,正确的是( )
A.过滤时,漏斗的下端管口紧靠烧杯内壁
B.为了加快过滤速度,可用玻璃棒搅动过滤器中的液体
C.当蒸发皿中的固体完全蒸干后,再停止加热
D.实验完毕后,用手直接取走蒸发皿
查看答案和解析>>
科目:高中化学 来源: 题型:
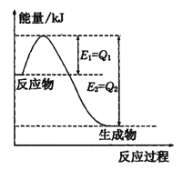
【题目】运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义。
(1)如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式____________(△H的数值用含字母Q1、Q2的代数式表示):
(2)已知:25℃时KSP(AgCl)=1.6×l0-10KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,从难溶电解质的溶解平衡角度解释产生沉淀的原因是 ,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(3)氨气溶于水得到氨水。在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后体积为混合前体积之和),反应后溶液显中性。求25℃下该混合溶液中氨水的电离平衡常数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com