
| V |
| Vm |
| m |
| ρ |
| n |
| V |
| 700L |
| 22.4L/mol |
| 700 |
| 22.4 |
| 700 |
| 22.4 |
| 17×700 |
| 22.4 |
1000g+
| ||
| 900g/L |
| 224+17×7 |
| 9×22.4 |
| ||
|
| 46×0.2g |
| 2 |
| 46 |
| 62 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
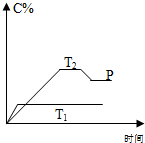 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 需加入的药品 | 离子方程式 |
| CaCl2( CaCO3) | ||
| FeSO4 (CuSO4) | ||
| Cu(Al) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
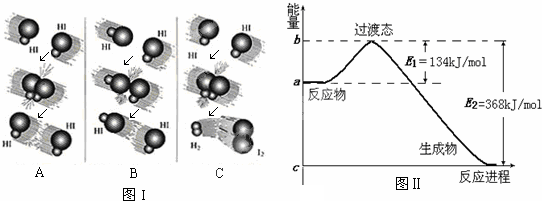
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com