
科目:高中化学 来源:2015-2016学年吉林省高二上11月月考化学试卷(解析版) 题型:选择题
下列物质中,不能发生消去反应的是
 B.CH2 BrCH2Br
B.CH2 BrCH2Br
 D.CH2ClCH2CH3
D.CH2ClCH2CH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
下列化学反应的离子方程式正确的是
A.碳酸钙与盐酸溶液反应:2H+ + CO32- = H2O + CO2
B.铁钉放入稀硫酸中:2Fe + 6H+ = 2Fe 3+ + 3H2↑
C.碳酸氢钠与稀盐酸反应:HCO3-+ H+ = CO2↑ + H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2+ + SO42- + H+ + OH- = BaSO4↓ + H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第四次月考化学试卷(解析版) 题型:选择题
有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为 。有机物X的键线式为
。有机物X的键线式为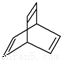 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.X的化学式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为
C.X能使高锰酸钾酸性溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上11月月考化学试卷(解析版) 题型:选择题
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O
D.正极上发生的反应是:O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上期中测试化学试卷(解析版) 题型:选择题
质量分数为a%,物质的量浓度为c mol•L﹣1的NaCl溶液,蒸发溶剂,恢复到原来的温度,若物质的量浓度变为2c mol•L﹣1,则质量分数变为(蒸发过程中没有晶体析出,且NaCl溶液的密度大于1g/mL)
A. 等于2a% B. 大于2a% C. 小于2a% D. 无法确定
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:实验题
某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。经小组讨论,他们设计了如下装置进行实验。烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1、C4中装有碱石灰,试管E1、E3、E4中装有澄清石灰水。
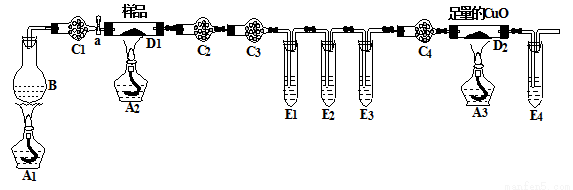
(1)充分反应后,将D1中的固体残余物投入足量经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为 。
(2)该实验装置中有3个酒精灯,至少应该点 次酒精灯,最先点燃的酒精灯是 ,最后点燃的是 。
(3)该实验装置中有4个直立的试管,它们与盛放试剂体现不同的作用,其中E2的作用是: 。
(4)该实验装置中有4个干燥管,C3中盛装的试剂是 。
(5)取7.2 g样品充分反应后,测得D1中的固体残余物为2.88 g,D2中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上第二次质检化学试卷(解析版) 题型:填空题
利用钛白工业的副产品FeSO4(含少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:①5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
②5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有___________;
(2)滤液经处理可得到副产品___________;
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2mol/L的H2SO4溶解
步骤2:用0.2000mol/L标准KMnO4溶液与其反应,消耗其体积30.40mL。
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2mol/L的H2SO4溶液,将Fe3+还原为Fe2+
步骤4:过滤,滤液用上述标准KMnO4溶液进行反应,消耗溶液10.00mL.
则样品中C2O42-的物质的量为__________;(写出计算过程);
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为__________;

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com