
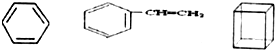
 组成的混合物中碳的质量分数为92.3%.
组成的混合物中碳的质量分数为92.3%. 科目:高中化学 来源: 题型:选择题
| A. | 乙烯可使溴的四氯化碳溶液褪色 | B. | 乙醇难溶于水,密度比水小 | ||
| C. | 氧化镁用于电解冶炼单质镁 | D. | 二氧化硅用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
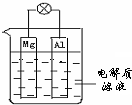 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 能使漂白粉水溶液先变浑浊后变澄清,SO2 也有同样现象 | |
| B. | 加热条件下,Na与O2反应生成Na2O2,Li与O2反应也生成过氧化锂 | |
| C. | 常温下,浓硝酸能使铁、铝钝化,浓硫酸也能使铁、铝钝化 | |
| D. | 铁可置换出硫酸铜溶液中的铜,钠也可置换出硫酸铜溶液中的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
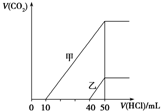
| A. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 | |
| B. | 当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为:OH-+H+═H2O | |
| C. | 乙溶液中含有的溶质是NaOH、NaHCO3 | |
| D. | 乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中只有一种阴离子(OH-除外) | B. | 溶液中溶质的物质的量之比为1:2 | ||
| C. | 反应后有CO2逸出 | D. | 反应后的溶液还可以吸收部分CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
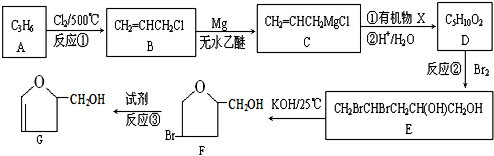

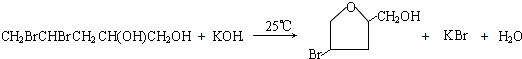 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com