
(8分)将一定量的氧化铜加入到100.Og质量分数为19.6%的硫酸溶液中,完全溶解后溶 液显蓝色,再加人19.6g铁粉充分反应后,经过滤、干燥得到的固体仍为19.6g。
(1)通过计算说明干燥后的固体是什么物质?
(2)求原氧化铜的质量。
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
(10分) 地下水中硝酸根离子、亚硝酸根离子会造成地下水污染,目前地下水中硝酸根离子经济可行的脱氮方法是在合适的催化剂作用下,用还原剂(如HCOONa)将硝酸根离子还原为氮气而脱氮。
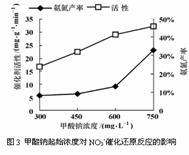
某化学研究性学习小组的同学在技术人员指导下,研究水样中硝酸根起始浓度为100 mg?L- 1条件下,用一定量的催化剂,以甲酸钠进行反硝化脱氮的效率及脱氮的最佳条件,实验中控制起始pH=4.5。经测定得到图1、图2及图3如下。


(1)地下水中硝酸盐可能来源于 ,地下水中硝酸盐含量的增大不仅影响人类和生物体的身体健康,还可能引起 等环境问题。(填一项)
(2)请写出用甲酸钠脱氮的主要离子方程式: 。
(3)分析图1,下列有关说法正确的是( )
A. NO2- 是反应过程中的中间产物
B.NH4+是反应中的一种副产物
C.反应30min后NO3-脱除速率降低,是因为硝酸根离子浓度降低
D.反应进行到75min时,溶液中含氧酸根离子脱除率最高
(4)由图2、图3分析,在本题实验条件下,用甲酸钠进行反硝化脱氮的合适条件:催化剂投入量为 ,甲酸钠起始浓度为 。
(5)根据图1计算,当反应进行至75min时,若NH4+浓度为3.8 mg?L-1,此时水样中氮的脱除效率为 %。(假设实验过程中溶液体积不变,结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物,它的蒸气密度是相同条件下空气密度的2.56倍。11.1g该有机物充分燃烧后的产物通过浓硫酸后增重8.1g,剩余气体通过足量澄清石灰水后生成45g白色沉淀。求:
(1)该有机物的分子式。
(2)该有机物有多种同分异构体,写出其中能水解的同分异构体的结构简式。
31.已知A为烃, B为烃的含氧衍生物. 由等物质的量的 A 和 B 组成的混合物 0.05 mol 在0.125 mol 的氧气中恰好完全燃烧, 生成 0.1 mol 的 CO2 和 0.1 mol H2O, 试通过计算回答下列问题:
(1)从分子式的角度看, 等物质的量A和B组成的混合物平均组成可用化学式表示为_________。
(2)另取一定量的A和B完全燃烧, 将其以任意物质的量比混合, 且物质的量之和一定,则:
①若耗氧量一定,则A和B的分子式分别为:
A ; B 。
②若生成的CO2和H2O的物质的量一定,则A和B的分子式为:
A ; B 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com