
【题目】碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程制得。
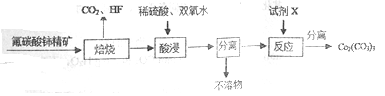
(1)如图是一种稀土元素铈(Ce)在元素周期表中的信息示意图。则铈原子的质子数是______,氟碳酸铈的化学式为CeFCO3,该化合物中,Ce的化合价为_____________;
(2)焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为______________;
(3)试剂X______________;
(4)已知298K时,Ksp[Ce(OH)4]=1×10-29,Ce(OH)4的溶度积表达式为Ksp=______________;为了使溶液中Ce4+沉淀完全,需调节pH为________以上;
(5)取某Ce(OH)4产品1.00g(质量分数为97%),加硫酸溶解后,用0.1000molL-1的FeSO4溶液滴定至终点(铈被还原成Ce3+)则需要滴加标准溶液的体积____________mL,若用硫酸酸化后改用0.1000molL-1
的FeCl2溶液滴定产品从而测定Ce(OH)4产品的质量分数,其它操作都正确,则测定的Ce(OH)4产品的质量分数__________(填“偏高”、“偏低”或“不变”)。
【答案】(1) 58 +3
(2)2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O
(3)Na2CO3
(4)c4(OH-)×c(Ce4+) 8
(5)46.6 偏低
【解析】
试题分析:(1)有信息示意图可知铈的核电荷数为58,即质子数为58;化合物中各元素化合价之和为0,CeFCO3中Ce的化合价为x,则x+(-1)+(+4)+(-2)×3=0,x=+3;
(2)二氧化铈的Ce为+4价,在酸浸时,固体CeO2 被溶解,且被还原为了+3价的Ce3+,在酸性条件下发生氧化还原反应,方程式为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(3)在酸浸后,经过分离不溶物,得到含有Ce3+的溶液,加入Na2CO3溶液,中和(2)中酸液,使Ce3+转化为Ce2(CO3)3沉淀;
(4)已知Ce(OH)4 (aq)![]() Ce4+(aq)+4OH-(aq),此反应的Ksp=c4(OH-)×c(Ce4+);当溶液中c(Ce4+)小于10-5mol/L时,沉淀完全,此时c4(OH-)=
Ce4+(aq)+4OH-(aq),此反应的Ksp=c4(OH-)×c(Ce4+);当溶液中c(Ce4+)小于10-5mol/L时,沉淀完全,此时c4(OH-)=![]() =1×10-24,则c(OH-)=1×10-6mol/L,此时溶液的pH=8;
=1×10-24,则c(OH-)=1×10-6mol/L,此时溶液的pH=8;
(5)Ce(OH)4产品在用硫酸溶解后生成了Ce4+,所以用还原剂滴定该溶液,Ce4+变成了Ce3+,而Fe2+被氧化成了Fe3+,所以根据电子的是守恒计算,n[Ce(OH)4]=n(FeSO4)=cV=0.1000 molL-1×V×10-3L=![]() mol,V=46.6;如果改用FeCl2溶液滴定,则Cl-也能被Ce4+氧化,实际消耗的标准液偏少,测定结果偏低。
mol,V=46.6;如果改用FeCl2溶液滴定,则Cl-也能被Ce4+氧化,实际消耗的标准液偏少,测定结果偏低。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:


(1)电解时的阳极反应方程式为____________________________________。
(2)除去ClO2中的NH3可选用的试剂为是_____(填标号)
A.水 B.浓硫酸 C.碱石灰 D.饱和食盐水
(3)用右图装置可以测定混合气中ClO2的含量:
I.在锥形瓶中加入足量的碘化钾,用50ml水溶解后,再加入3ml稀硫酸;
II.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
III.将一定量的混合气体通入锥形瓶中吸收;
IV.将玻璃液封装置中的水倒入锥形瓶中;
V.用0.2000mol/L 硫代酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32—===2I—+S4O62—),指示剂显示终点时共用去20.00ml硫代酸钠溶液。在此过程中:
①玻璃液封装置的作用是_________。
② V中加入的指示剂通常为______,滴定至终点的现象是______。
③测定混合气中ClO2的质量为______g。
④用此方法测定混合气中ClO2的质量常常偏高,可能的原因是_____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)铜是一种重要的有色金属,近年来用途越来越广泛。请回答下列问题:
(1)下列四种化合物中含铜量最高的是______(填字母)
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为________万吨。(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物。在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O)。
①该制备过程的反应方程式为____________________________________________。
②工业上常用的固液分离设备有________(填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值。但出土的青铜器大多受到环境腐蚀。右图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:

①腐蚀过程中,负极是____(填“a”“b”或“c”),正极反应方程式为_______________。
②环境中的Cl-扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是 ( )
氧化物 | 环境问题 | 主要来源 | |
A | CO2 | 酸雨 | 化石燃料的燃烧 |
B | SO2 | 光化学烟雾 | 汽车尾气的排放 |
C | NO2 | 温室效应 | 工厂废气的排放 |
D | CO | CO中毒 | 燃料的不完全燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
②与明矾相似,硫酸铁也可用作净水剂,其原理为:___________(用离子方程式表示)。
③FeC13与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________。
(2)己知:S2O32-具有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为:
S2O82-+2I-=2SO42-+I2 ① I2+2S2O32-=2I-+S4O62- ②
S2O82-、S4O62-、I2氧化性强弱顺序_______。
(3)己知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
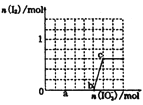
①a点处的还原产物是:________(填离子符号);
b点→c点反应的离子方程式是________。
②当溶液中的I-为0.5mol时、加入的KIO3可能是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________________。
(2)装置乙,若电路中转移6.02×1022个e﹣,则C上增加的质量为 。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在生产、生活和科研中应用十分广泛。
(1)①SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) ![]() 4N2(g)+6H2O(g)△H=-1627.2kJmol-1;
4N2(g)+6H2O(g)△H=-1627.2kJmol-1;
6NO(g)+4NH3(g) ![]() 5N2(g)+6H2O(g)△H=-1807.0kJmol-1;
5N2(g)+6H2O(g)△H=-1807.0kJmol-1;
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)△H=-2659.9kJmol-1;
7N2(g)+12H2O(g)△H=-2659.9kJmol-1;
反应N2(g)+O2(g) ![]() 2NO(g)的△H= ____________ kJmol-1
2NO(g)的△H= ____________ kJmol-1
②液氨可以发生电离:2NH3(l) ![]() NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
(2)氨气易液化,便于储运①若在恒温恒容的容器内进行反应2NH3(g) ![]() N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
A.容器中混合气体的密度保持不变
B.NH3(g)百分含量保持不变
C.容器中混合气体的压强保持不变
D.有3个H-H键生成同时又1个N≡N键生成
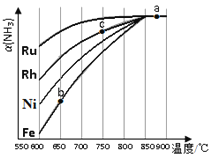
②其他条件相同时,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如图所示.在600℃时催化效果最好的是____________(填催化剂的化学式).c点氨气的转化率高于b点,原因是____________。
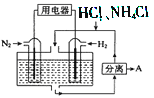
(3)如图表示使用新型电极材料,以N2、H2 为电极反应物,以HCl-NH4Cl为电解质溶液组成的既能提供能量又能实现氮固定的新型电池。请写出该电池的正极反应式____________;生产中可分离出的物质A的化学式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com