
分析 500t 98%的硫酸中纯硫酸的质量=500t×98%=490t,根据S原子守恒得关系式FeS2----H2SO4,根据二硫化亚铁与硫酸之间的关系式进行计算.
解答 解:500t 98%的硫酸中纯硫酸的质量=500t×98%=490t,根据S原子守恒得关系式FeS2----2H2SO4,
设需要原料矿石为x,
FeS2------------------2H2SO4
120 98×2
x×80%×95%×90%×98% 490t
120:196=(x×80%×95%×90%×98%):490t
x=$\frac{490t×120}{196×80%×95%×90%×98%}$=447.5t,
答:需要原料矿石447.5t.
点评 本题考查化学方程式的有关计算,侧重考查学生计算能力,明确二硫化亚铁与硫酸的关系式即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向AlCl3溶液中滴加氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe2O3与氢碘酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混合物中铜的质量为19.2 g | |
| B. | 与该混合物反应消耗的HNO3的量为1.2 mol | |
| C. | 加入NaOH溶液的体积是800 mL | |
| D. | Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③②①④ | C. | ②③①④ | D. | ②①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na+、Ba2+、Cl-、SO42- | B. | Na+、Ba2+、AlO2-、NO3- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Na+、K+、NO3-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaCl+NaClO3+3H2O | |
| B. | Fe+CuSO4=FeSO4+Cu | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2Na+2HCl═2NaCl+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出0.5QkJ的热量 | B. | 吸收0.5QkJ的热量 | ||
| C. | 放出的热量小于0.5QkJ | D. | 吸收的热量小于0.5QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
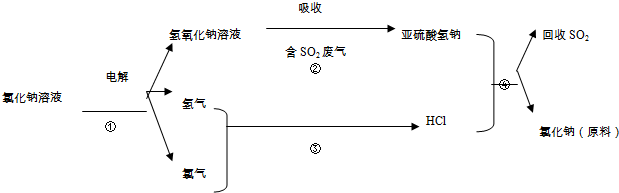
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com