
【题目】随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示。
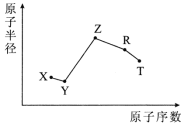
已知:TX2是现代光学及光纤制品的基本原料;
ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是___。
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的结构式为___。
(3)请用一个化学方程式比较X和Y的非金属性的强弱_____。
(4)工业上以Z3RY6作助熔剂的目的是____。
【答案】第3周期IIIA族 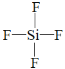 (或其他正确答案即可) 2F2+2H2O = 4HF+O2 降低氧化铝的熔融温度,节约冶炼铝的能源
(或其他正确答案即可) 2F2+2H2O = 4HF+O2 降低氧化铝的熔融温度,节约冶炼铝的能源
【解析】
TX2是现代光学及光纤制品的基本原料,则为SiO2,T为Si,X为O,根据半径大小得出Y为F,化合物ZY能破坏水的电离平衡,则Z为Na,Z3RY6在工业上常用作助熔剂,则为Na3AlF6,故R为Al。
⑴R为Al,核外电子排布为2、8、3,在元素周期表中的位置是第3周期IIIA族;故答案为:第3周期IIIA族。
⑵上述元素中的某两种元素可组成一种五原子共价化合物,该化合物是SiF4,该化合物的结构式为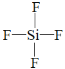 ;故答案为:
;故答案为: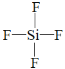 (或其他正确答案即可)。
(或其他正确答案即可)。
⑶比较F和O的非金属性,可利用氟气与水发生反应,置换出氧气的规律来证明,化学方程式为2F2+2H2O = 4HF+O2;
故答案是:2F2+2H2O = 4HF+O2;
⑷氧化铝熔点高,熔融时耗能大,因此工业上以Z3RY6作助熔剂的目的是降低氧化铝的熔融温度,节约冶炼铝的能源;
故答案为:降低氧化铝的熔融温度,节约冶炼铝的能源。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B.P4和CH4都是正四面体形分子且键角都为109°28′
C.![]() 的电子式为
的电子式为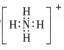 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学无处不在,下列说法不正确的是![]()
A.硅既可制作光导纤维,也可制作电脑芯片
B.乙酸既可做调味剂,也可除水垢
C.氢氧化铝既可做阻燃剂,也可治疗胃酸过多
D.食盐既可做融雪剂,也可做防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图一装置制备氨气并探究相关性质。
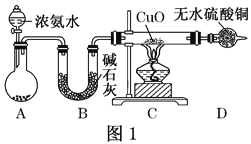
(1)装置A中,盛有浓氨水的仪器名称为_____,烧瓶内药品可选用______。装置B的作用是______。
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_____(填I或Ⅱ)。
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为______,该反应证明氨气具有______性;氨跟氧气的反应也体现了这一性质,反应方程式为______。
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_____(填装置序号)。
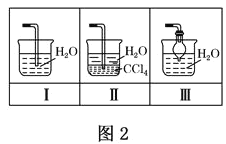
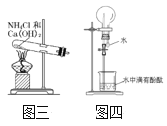
(5)实验室还可用图三所示装置制备氨气,化学反应方程式为_____;用圆底烧瓶收集干燥的氨气,用图四装置进行喷泉实验,挤压胶头滴管时,可以得到红色喷泉,原因(用方程式表示)是______。
(6)尿素CO(NH2)2是一种常用化肥,缓慢与水发生非氧化还原反应释放出氨气,则尿素中C的化合价为价_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
D | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:

(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是______
A.H2SO4 B.HCl C.HNO3
(2)除去滤液1中Cu2+的离子方程式是___________________________
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中![]() <0.7时,滤液1中能够检验出有Fe2+;
<0.7时,滤液1中能够检验出有Fe2+;![]() ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
①检验Fe2+是否氧化完全的实验试剂是__________ A.KSCN B.K3Fe(CN)6
②若![]() >1,调节
>1,调节![]() 到0.7~1的最理想试剂是_______(填序号)
到0.7~1的最理想试剂是_______(填序号)
a.NaOH溶液 b.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是( )
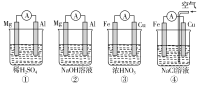
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.④中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
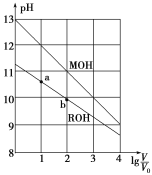
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在平衡Cl2+H2O![]() HCl+HClO,HClO
HCl+HClO,HClO![]() H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
A.H2SB.NaHCO3C.盐酸D.NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com