
| A、Ksp只与难溶电解质的性质和温度有关 |
| B、由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C、任意两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
| D、t℃时,Ksp(CaCO3)=4×10-16,则CaCO3饱和溶液中c(Ca2+)=2×10-8 mol/L |


科目:高中化学 来源: 题型:
A、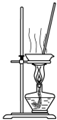 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
B、 制取少量乙烯气体 |
C、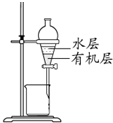 分离CCl4萃取溴水后已分层的有机层和水层 |
D、 装置制取少量Cl2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m1>m2 |
| B、m1≤m2 |
| C、m1≥m2 |
| D、m1=m2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
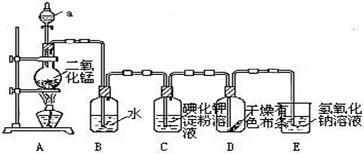
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgNO3 (Ag2O) |
| B、NaOH(NaOH) |
| C、NaCl (盐酸) |
| D、CuSO4(Cu(OH)2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7,c(SO42-)=c(NH4+) | ||
| B、两种醋酸溶液物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | ||
D、向0.1moL?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g)△H=366KJ?mol-1 |
| B、氢气和氯气反应生成2 mol氯化氢气体,反应的△H=366KJ?mol-1 |
| C、氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ?mol-1 |
| D、氢气和氯气反应生成1 mol氯化氢气气体,反应的△H=-183KJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com