
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙(其pH变色范围为3.1~4.4)作指示剂,下列操作中可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准盐酸润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2016届福建省闽粤联合体高三上学期第三次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023
B.V L a mol·L﹣1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl﹣的数目大于3×6.02×1023
C.标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023
D.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数为0.5×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:选择题
25℃时,用0.1mol/L的CH3COOH溶液滴定20mL0.1 mol/L的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是
A.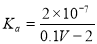 B.
B.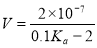 C.
C.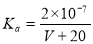 D.
D.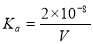
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第三次月考化学试卷(解析版) 题型:填空题
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。(已知25℃Ksp[Fe(OH)3]=4.0×10﹣38 lg2=0.3)
请回答下列问题:
(1)FeCl3 净水的原理是____________ 。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为_________________(填写数值)。
(2)将FeCl3 溶液与NaHCO3 溶液混合,其离子方程式为 _______________。
(3)25℃时pH=3的溶液中,c(Fe3+)= mol•L﹣1要使Fe3+ 沉淀完全,pH应大于________。
(4)FeCl3 在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3=CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:选择题
电瓶车所用电池一般为铅蓄电池(如图),是一种的可充电电池,电池总反应式为:
Pb+PbO2+2H2 SO4 2Pb SO4+2H2O。则下列说法正确的是
2Pb SO4+2H2O。则下列说法正确的是
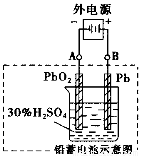
A.放电时,负极板上发生了还原反应
B.放电时,正极反应是:Pb-2e一+ SO42—=PbSO4
C.充电时,铅蓄电池的负极应与充电器电源的正极相连
D.充电时,阳极反应是:PbSO4-2e一+2H2O= PbO2+ SO42—+4H+
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次月考化学试卷(解析版) 题型:选择题
原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征,下列各对粒子中,空间结构相似的是
①CS2与NO2 ②CO2与N2O ③SO2与O3 ④PCl3与BF3
A.①②③ B.③④ C.②③④ D.②③
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO32- 、SiO32-、AlO2- 、Cl- |
阳离子 | Al3+、Fe3+、Mg2+、NH4+ 、Na+ |
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示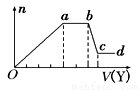 下列说法正确的是
下列说法正确的是
A.若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和Na+
B.若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+ 物质的量之比为1:1:2
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上12月模拟化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O=[Al(OH)4]- + 4NH4+
B.澄清石灰水与过量苏打溶液反应:Ca2+ + HCO3-+ OH-=CaCO3↓+ H2O
C.碳酸钙溶于醋酸:CaCO3 + 2H+=Ca2+ +CO2↑+ H2O
D.碘化亚铁中通入氯气:2I-+ Cl2=I2 + 2Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
某同学按照课本实验要求,用50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )
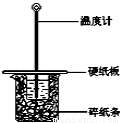
A.实验过程中没有热量损失
B.烧杯间填满碎纸条的作用是固定小烧杯
C.图中实验装置缺少环形玻璃搅拌棒
D.若烧杯上不盖硬纸板,测得的△H将偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com