
| A. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | NaHCO3溶液中加入足量的Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 钠和水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
分析 A.次氯酸钙溶液中通入过量二氧化碳,反应生成碳酸氢根离子,不会生成碳酸钙沉淀;
B.氢氧化钡足量,反应生成碳酸钡沉淀、氢氧化钠和水;
C.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒;
D.次氯酸为弱酸,离子方程式中次氯酸不能拆开.
解答 解:A.二氧化碳足量,反应生成碳酸氢钙和次氯酸,正确的离子方程式为:ClO-+H2O+CO2═HClO+HCO3-,故A错误;
B.NaHCO3溶液中加入足量的Ba(OH)2溶液,反应生成碳酸钡沉淀、氢氧化钠和水,反应的离子方程式为:HCO3-+Ba2++OH-═BaCO3↓+H2O,故B正确;
C.钠和水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D.次氯酸溶于水生成氯化氢和次氯酸,次氯酸不能拆开,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | Si投入NaOH溶液中 Si+2OH-═SiO32-+H2 | |
| B. | 把 Al中投入到少量氢氧化钠溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | 向明矾溶液中加入氢氧化钡溶液,恰好使“SO42-”完全沉淀 Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ | |
| D. | Na[Al(OH)4]溶液中加入过量CO2[Al(OH)4]-+CO2═HCO3-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| C. | 未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在0.1 mol•L-1 NaHS溶液中:c(H+)=c(S2-)+c(OH-)+c(HS-) | |
| C. | 将0.1 mol•L-1 Na2CO3溶液和0.2 mol•L-1 NaHCO3溶液等体积混合:3c(Na+)=4c(CO32-)+4c(HCO3-) | |
| D. | 向0.1 mol•L-1 NaHSO4溶液中滴加氨水至溶液恰好呈中性:c(Na+)=c(NH4+)=c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
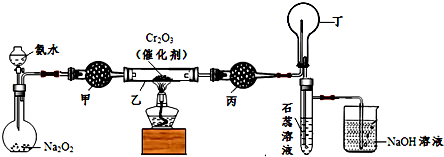
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y 的最低负化合价为一2,则Z的最高正化合价为+7 | |
| D. | 若X 的最高正化合价为十5,则五种元素一定都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
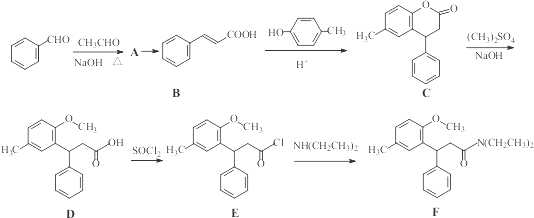
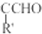
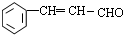 .
.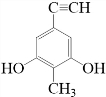 等.(任写一种)
等.(任写一种)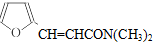 )是一种高效麻醉剂,写出以
)是一种高效麻醉剂,写出以 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com