
【题目】下列有关氯及其化合物说法中正确的是
A.氯气是一种黄绿色、有毒的气体,能使干燥有色布条褪色
B.氯气性质活泼,因此液氯不宜贮存在钢瓶中
C.实验室可用饱和食盐水除去氯气中混有的少量氯化氢气体
D.氯化钠溶液可直接用于制备金属钠、纯碱和氢氧化钠
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
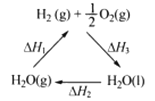
下列说法不正确的是
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与浓硫酸反应,随着硫酸的浓度下降,产生的气体中混有H2,为证实相关分析,化学小组的同学设计了如图所示的实验装置,对反应后的气体(X)取样进行组分分析(遇有气体吸收过程,视为完全吸收)。
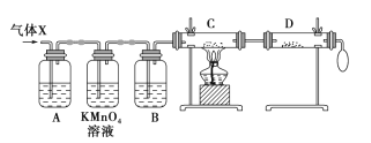
(1)A中加入的试剂可能是_________,若高锰酸钾溶液与B 之间不再添加装置,请描述观察到何种现象能表明已达到使用高锰酸钾溶液的目的_______________。
(2)可证实气体 X 中混有较多氢气的实验现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
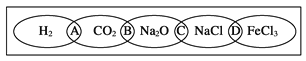
(1)请将分类依据代号填入相应的括号内:
(_______________)两种物质都不是电解质
(________________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为________________。
②证明有红褐色胶体生成的实验操作是____。
(Ⅱ)反应:
A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水只是氧化剂的是______(填序号),反应B中被氧化的元素名称是________。
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O, 硝酸在该反应中的作用是______ 还原剂与氧化剂的物质的量之比:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2HCHO2H2O)俗称吊白块,在印染、医药以及原子能工业中有广 泛应用。以 Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: 已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在 120℃以上发生分解。
步骤 1:在三颈烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,缓慢通入 SO2,至溶液 pH 约为 4,制得 NaHSO3溶液。
步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在 80~90℃下, 反应约 3h,冷却至室温,抽滤;
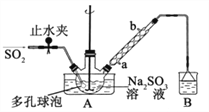
步骤 3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置 B的烧杯中应加入的溶液是_________;冷凝管中冷却水从_______填“a”或“b”)口进水。
(2)A 中多孔球泡的作用是________。
(3)冷凝管中回流的主要物质除 H2O 外还有________(填化学式)。
(4)写出步骤 2 中发生反应的化学方程式________。
(5)步骤 3 中在真空容器中蒸发浓缩的原因是________。
(6)为了测定产品的纯度,准确称取 2.0g 样品,完全溶于水配成 100mL 溶液,取 20.00mL 所配溶液, 加入过量碘完全反应后(已知 I2 不能氧化甲醛,杂质不反应),加入 BaCl2 溶液至沉淀完全,过滤、洗涤、 干燥至恒重得到白色固体 0.466g,则所制得的产品的纯度为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或电离方程式书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.硝酸银溶液中加入铁粉:Ag++Fe=Fe2++Ag
C.硫酸氢钠的电离方程式:NaHSO4=Na+ + H+ + SO42-
D.碳酸氢钠的电离方程式:NaHCO3=Na+ + H++ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是
A. 电解熔融NaCl制取金属钠的反应中,钠离子被还原,氯离子被氧化
B. 湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e
D. 铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R-NO2![]() R-NH2;②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:
R-NH2;②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是______________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①②物质的结构简式:①__________,②_______。
(3)苯的二氯代物有________种同分异构体。
(4)有机物 的所有原子________(填“是”或“不是”)在同一平面上。
的所有原子________(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组同学设计如图实验装置(部分夹持仪器未画出)探究氨气的还原性并检验部分产物。
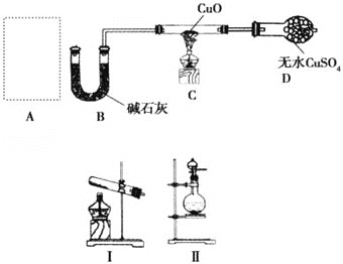
(1)若A中使用装置Ⅰ制取氨气,则化学方程式为__,发生装置试管口略向下倾斜的原因_____;若A中使用装置Ⅱ制取氨气,则分液漏斗中的试剂为__,圆底烧瓶中的固体可以为__。
(2)B中碱石灰的作用是__。
(3)氨气还原炽热氧化铜的化学方程式为__,装置C中的实验现象为__,装置D中的实验现象为__。
(4)①该装置存在明显的缺陷是__。
②请画出改进后需要增加连接的实验装置图________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com