


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
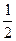 O2(g)
O2(g) SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3溶液 | B.AlCl3溶液 | C.Na2S溶液 | D.AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2 | B.SO3 O2 | C.SO2 O2 | D.SO2 SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 陈述I | 陈述Ⅱ | 判断 |
| A | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | I对;Ⅱ对;有 |
| B | Cl2和SO2混合后可用于漂白纸浆 | Cl2和SO2都有较好的漂白作用 | I对;Ⅱ错;无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的光 | I对;Ⅱ对;无 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | I对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S的氧化性 | B.SO2的还原性 |
| C.S的漂白性 | D.SO2的漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com