

分析 钡矿粉的主要成分BaCO3(含有SiO2、Fe2+、Mg2+等),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,过滤除去不溶物SiO2,滤液中加入H2O2将Fe2+氧化为Fe3+,再加入氢氧化钠溶液调节溶液pH,使Fe3+转化为Fe(OH)3沉淀过滤除去,溶液中主要含Mg2+、Ba2+,加20%NaOH溶液调节pH=12.5,沉淀镁离子,过滤,滤液中加入盐酸酸化,再通过加热浓缩、冷却结晶、过滤等操作得到BaCl2•2H2O晶体,将晶体与NH4F溶液反应制备氟化钡,据此分析解答.
解答 解:(1)钡矿粉的主要成分BaCO3(含有SiO2、Fe2+、Mg2+等),加盐酸溶解,SiO2不溶于盐酸,过滤,故滤渣A为SiO2;
故答案为:SiO2;
(2)加过氧化氢的目的是氧化亚铁离子为铁离子,便于除去,反应为:H2O2+2Fe2++2H+=2Fe3++2H2O;
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(3)滤液2的金属离子为Mg2+、Ba2+,加20%NaOH溶液调节pH=12.5,沉淀镁离子,故滤渣C为Mg(OH)2;
故答案为:Mg(OH)2;
(4)滤液3中加入盐酸酸化,再通过加热浓缩、冷却结晶、过滤等操作得到BaCl2•2H2O晶体;
故答案为:加热浓缩;过滤;
(5)BaCl2•2H2O晶体与NH4F溶液反应制备氟化钡,反应物为:Ba2++2F?=BaF2↓,己知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5L),至少需要的氟离子浓度是$\sqrt{\frac{1.84×1{0}^{-7}}{1{0}^{-5}}}$mol/L=0.136mol/L;
故答案为:Ba2++2F?=BaF2↓;0.136;
(6)将氯化钡溶液滴入等物质的量浓度的硫酸钠和碳酸钠混合液中,当BaCO3开始沉淀时,溶液中$\frac{c(C{O}_{3}^{2-})}{c(S{O}_{4}^{2-})}$=$\frac{c(C{{O}_{3}}^{2-})•c(B{a}^{2+})}{c(S{{O}_{4}}^{2-})•c(B{a}^{2+})}$=$\frac{Ksp(BaC{O}_{3})}{Ksp(BaS{O}_{4})}$=24.1;
故答案为:24.1.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:实验题
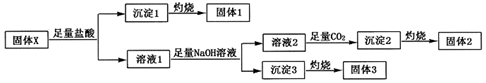
 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁酮的催化加氢反应 | B. | 丙酮与HCN发生加成反应 | ||
| C. | 乙醛与乙醛反应生成2-羟基丁醛 | D. | 乙苯与酸性高锰酸钾溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | pH |
| NaF | 7.5 |
| Na2CO3 | 11.6 |
| NaClO | 9.7 |
| NaHCO3 | 8.3 |
| A. | 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO | |
| B. | 水解方程式:F-+H2O?HF+OH-的平衡常数为1×10-13 | |
| C. | 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| D. | 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | HClO的漂白性是因为酸性很弱 | |
| B. | 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大 | |
| C. | 反应 2C1O-+CO2+H2O=CO32-+2HClO可以发生 | |
| D. | 稀释醋酸溶液,则$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$的数值随水量的增加而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子数 | B. | 烷基位置编号 | C. | 氢原子数 | D. | 同种烷基数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 寺院内铜佛像用导线与直流电源的正极连接可以防锈 | |
| B. | 家厨内铁锅洗净后未擦干易生锈主要是发生了化学腐蚀 | |
| C. | 红葡萄酒密封贮存越久越香可能是因为缓慢生成了酯类物质 | |
| D. | 液氯泄漏时,可用肥皂水浸湿的毛巾捂鼻俯卧于低处等待救援 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)用“=”、“>”、“<”填写下表
(1)用“=”、“>”、“<”填写下表 | 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O <N | Cl <F | NaCl >KBr | HF >HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com