
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸 溶液 |
MnSO4固体 | 0.10mol/L KMnO4溶液 |
褪色 时间 |
| 1 | 650C | ---- | --- | 1mL | 1OOs |
| 2 | 650C | 10滴 | --- | 1mL | 90s |
| 3 | 750C | 10滴 | ---- | 1mL | 40s |
| 4 | 750C | 10滴 | 加入少许 | 1mL | 3s |
| 实验步骤 | 预期现象和结论 |
| 将很少量Cl2通入过量的FeI2溶液中; 取少量反应后溶液分置于A、B两试管中;往A中滴加 往往B中滴加 |
若 则假设1成立; 若 则假设2成立. |
| 5×V×10-3L×0.10mol/L |
| 2 |
| 2.5V×10-5mol×126g/mol |
| Wg |
| 31.5V |
| W |
| 31.5V |
| W |
| 实验步骤 | 预期现象和结论 |
| 将很少量Cl2通入过量的FeI2溶液中; 取少量反应后溶液分置于A、B两试管中;往A中滴加 KSCN溶液.振荡: 往往B中滴加 淀粉溶液.振荡? |
若 A变红色,B不变色. 则假设1成立; 若 A不变色,B变蓝色. 则假设2成立. |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
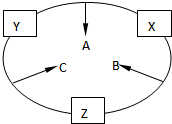 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硫酸的电离:H2SO3?2H++SO32- |
| B、氯化铵水解的离子方程式为:NH4++H2O?NH3?H2O+H+ |
| C、NaHCO3水解的离子方程式为:HCO3-+H2O?CO32-+H3O+ |
| D、向氯化铝溶液中加入过量的氨水:A13++3NH3?H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用如图装置完成表中的四个实验,不能得到实验目的是( )
实验室用如图装置完成表中的四个实验,不能得到实验目的是( )
| 选项 | 实验目的 | M | N |
| A | 检验铜与浓硫酸反应的气体产物 | 品红 | NaOH |
| B | 检验CH3CH2Br消去后产生的气体 | 水 | KMnO4溶液 |
| C | 制取乙炔时检验气体产物 | CuSO4溶液 | KMnO4溶液 |
| D | 验证醋酸、碳酸、苯酚酸性强弱 | NaOH溶液 | 苯酚钠溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
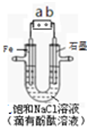 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )| A、a为电源的正极 |
| B、通电一段时间后,石墨电极附近溶液先变红 |
| C、Fe电极的电极反应是4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水的总反应是:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 元素及其化合物在生产、生活中具有广泛的用途.
元素及其化合物在生产、生活中具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com