
| A. |  火炬燃烧 | B. |  风力发电 | C. |  粮食酿醋 | D. |  高炉炼铁 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
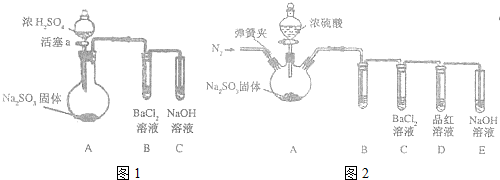
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
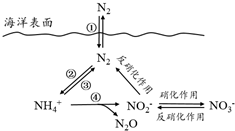 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.| 温度/℃ | 样本氨氮含量/mg | 处理24h | 处理48h |
| 氨氮含量/mg | 氨氮含量/mg | ||
| 20 | 1008 | 838 | 788 |
| 25 | 1008 | 757 | 468 |
| 30 | 1008 | 798 | 600 |
| 40 | 1008 | 977 | 910 |
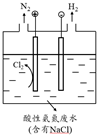
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2s内的平均反应速率υ(N2)=1.875×10-4mol•L-1•s-1 | |
| B. | 在该温度下,反应的平衡常数K=5 | |
| C. | 若将容积缩小为原来的一半,NO转化率大于90% | |
| D. | 使用催化剂可以提高单位时间CO和NO的处理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
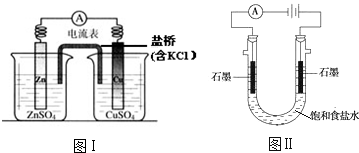
| A. | 图Ⅰ,电流形成的完整过程是:负极Zn-2e-═Zn2+,电子经导线流向正极,正极Cu2++2e-═Cu | |
| B. | 图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4,用石墨替换Cu棒 | |
| C. | 图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e-═H2↑ | |
| D. | 图Ⅱ,通电后,由于OH-向阳极迁移,导致阳极附近pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/LNH3.H2O溶液与0.1mol/L盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性:c(CH3COOH)>c(CH3COO-) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)=c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol/L Na2CO3溶液与0.1mol/LNaHSO4溶液等体积混合所得溶液:c(CO32-)+2 c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com