
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.033g |
分析 (1)实验需要药品的称量以及加热操作,以此判断所用的仪器;
(2)由表中数据可知W3-W1为硫酸铜的质量,W2-W3为结晶水的质量,计算两次的平均值,可计算x并判断误差;
(3)实验结果偏低,在测定中若被测样品中含有加热不挥发的杂质或实验前被测样品已有部分失水,都会造成测量结果偏低;
(4)第三、四次称量为恒重操作,以判断晶体是否完全分解,且取平均值而减小实验误差.
解答 解:(1)实验时应先研磨,需要研钵;然后称量需要电子天平;加热需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架坩埚、泥三角,最后在干燥器中冷却.
故答案为:ABDF;泥三角;
(2)由表中数据可知W3-W1为硫酸铜的质量,为$\frac{(16.962-15.688)+(17.033-15.688)}{2}$=1.3095(g),
W2-W3为结晶水的质量,为$\frac{(17.668-16.962)+(17.744-17.033)}{2}$=0.7085(g),
则x=$\frac{\frac{0.7085g}{18g/mol}}{\frac{1.3095g}{160g/mol}}$=4.81,
相对误差为$\frac{4.81-5}{5}×100%$=-3.8%,
故答案为:4.81;-3.8%;
(3)由(2)计算数值可知实验结果偏低,
A.加热前所用的坩埚未完全干燥.加热后水挥发,导致水的质量测定结果偏大,故A错误;
B.最后两次加热后的质量相差较大(大于0.001g),可能为水没有分解完全,则测定结果偏低,故B正确;
C.加热后容器未放入干燥器中冷却,硫酸铜吸水,导致测定结果偏小,故C正确;
D.加热过程中晶体有少量溅失,导致质量差值偏大,测定结果偏大,故D错误.
故答案为:偏低;BC;
(4)在硫酸铜结晶水含量的测定实验中,实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.001gg为止,一般情况下,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,
故答案为:恒重;直到连续两次称量误差不得超过0.001g为止.
点评 本题考查了硫酸铜晶体中结晶水的测定,为高频考点,侧重于学生的分析能力和实验能力的考查,把握实验操作原理及实验注意事项是解题的关键,此题实际上就来源于课本的学生实验,只要学生认真的去操作过、体验过、思考过,就会觉得很熟悉,题目难度中等.


科目:高中化学 来源: 题型:实验题
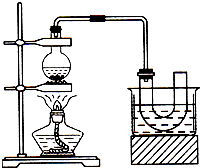 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
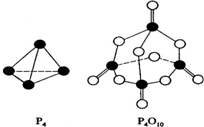
 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
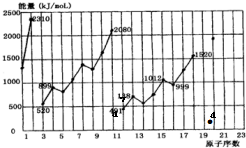
 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
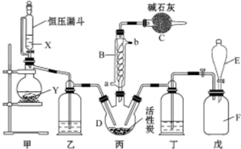 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.
磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
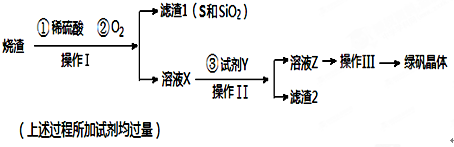
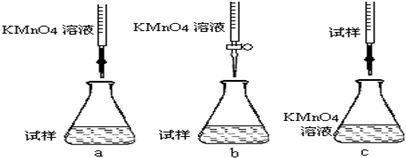
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应混合物的浓度改变 | B. | 反应混合物的压强改变 | ||
| C. | 正、逆反应速率改变 | D. | 反应物的转化率改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+,K+,MnO4-,Cl- | B. | Na+,H+,NO3-,SO42- | ||
| C. | K+,Ca2+,NO3-,CO32- | D. | Cu2+,Na+,Cl-,SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com