
| A. | H2O2既是氧化剂又是还原剂 | B. | H2O2是氧化剂 | ||
| C. | O2既是氧化产物又是还原产物 | D. | 该反应转移4mole- |
分析 2H2O2═2H2O+O2↑中,O元素的化合价由-1价升高为0,O元素的化合价由-1价降低为-2价,以此来解答.
解答 解:A.O元素的化合价由-1价升高为0,O元素的化合价由-1价降低为-2价,则H2O2既是氧化剂又是还原剂,故A正确;
B.H2O2既是氧化剂又是还原剂,故B错误;
C.O元素的化合价由-1价升高为0,失去电子被氧化,则O2是氧化产物,故C错误;
D.该反应中生成1molO2转移2mole-,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意利用化合价变化计算转移电子,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 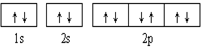 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 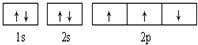 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 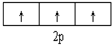 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 300 | 500 | 830 |
| 平衡常数K | 12 | 9 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是银白色、有一定延展性的金属,硬度很大 | |
| B. | 将钠放在石棉网用酒精灯加热,钠剧烈燃烧,产生黄色火焰,生成过氧化钠 | |
| C. | 金属钠在空气中燃烧,因氧气浓度低,生成氧化钠 | |
| D. | 钠保存在煤油中,也可保存在CCl4中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(OH)3溶液氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,金属单质一定是还原剂,非金属单质一定是氧化剂 | |
| B. | 某元素在化学反应中,由化合态变为游离态,则该元素一定被还原 | |
| C. | 在氧化还原反应中,氧化剂和还原剂可能是同一种物质 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图1中a~f分别表示有H、C、N、Na、Si、Cu元素组成的单质,其中c、d均是热和电的良导体,单质分别对应的熔点如图所示:
图1中a~f分别表示有H、C、N、Na、Si、Cu元素组成的单质,其中c、d均是热和电的良导体,单质分别对应的熔点如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L Na2CO3溶液:C(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] | |
| B. | 0.1 mol/L NH4Cl溶液:C(NH4+ )=C(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:C(Na+)>C(CH3COO-)>C(H+)>C(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:C(Na+)>C(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com