
| A. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| B. | 可以用NaOH溶液除去乙酸乙酯中的乙醇 | |
| C. | 天然油脂的主要成分是高级脂肪酸 | |
| D. | CH≡CH和CH2=CHCH=CH2互为同系物 |
分析 A.纤维素和淀粉都是多糖,水解的最终产物都是葡萄糖;
B.乙酸乙酯可以和氢氧化钠发生反应而乙醇与氢氧化钠不反应;
C.油脂的成分为高级脂肪酸甘油酯;
D.同系物结构相似,官能团相同.
解答 解:A.纤维素、淀粉水解的最终产物都是葡萄糖,故A正确;
B.乙酸乙酯可以和氢氧化钠发生反应,而乙醇不与氢氧化钠反应,不能用NaOH溶液可以除去乙酸乙酯中的乙醇,故B错误;
C.天然油脂的主要成分是高级脂肪酸混甘油酯分子构成的混合物,故C错误;
D.CH≡CH和CH2=CHCH=CH2二者所含官能团不同,所以结构不同,不属于同系物,故D错误;
故选:A.
点评 本题考查了淀粉、纤维素、酯的性质及同系物的判断,熟悉常见有机物的结构及性质是解题关键,注意同系物必须结构相似,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:解答题
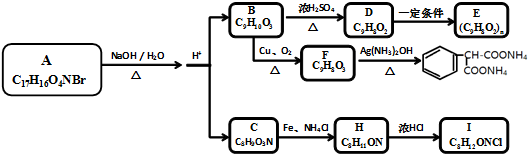
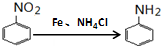
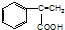 ,C→H的反应类型是还原反应.
,C→H的反应类型是还原反应.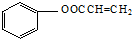 ,
,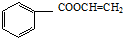 .
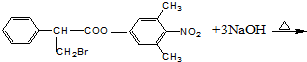
.
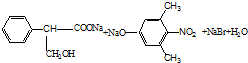 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
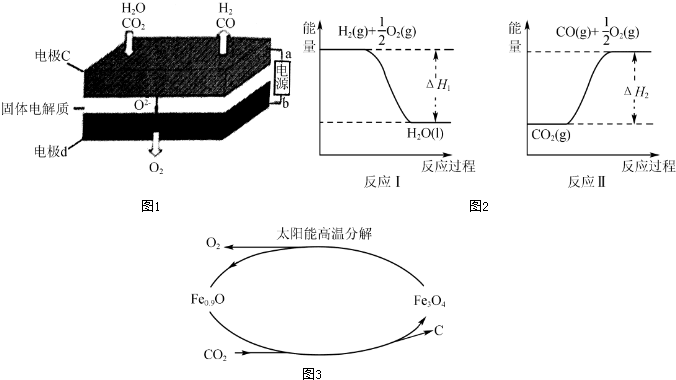
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知A-+H2B(过量)=HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在25℃时,将cmol/L的醋酸溶液与0.02mol/LNaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) | |
| C. | 若将CO2 通入0.1 mol/LNaOH溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol/L | |
| D. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| M | Y | Z |
| A. | 原子半径大小为Z>Y>M>X | |
| B. | 最高价氧化物的水化物的酸性强弱为X>Z>Y>M | |
| C. | 均形成简单离子,简单离子半径大小为M>Y>Z>X | |
| D. | X、M或Y、M不可能同为金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
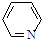 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
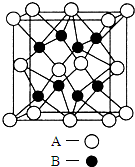 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SnH4>GeH4>SiH4>CH4 | B. | SbH3>AsH3>PH3>NH3 | ||
| C. | HI>HBr>HCl>HF | D. | H2Te>H2Se>H2S>H2O |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:实验题
碱式碳酸钴[Co4(OH),(CO3)4]常用作电子材料、磁性材料的添加剂,难溶于水,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置(不完整)进行试验。
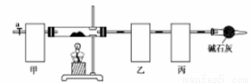
实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,…… ;
③加热硬质玻璃管,当乙装置中 ……,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(1)从下列图示选出合理的装置填于方框中,使整套实验装置完整(选填字母序号,可重复选)
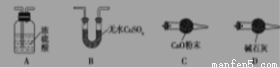
甲: 乙: 丙:
甲装置的作用是 。
(2)步骤②中省略的实验操作为 ;
步骤③中乙装置的现象为 ;
步骤④中缓缓通入空气数分钟的目的是 。
(3)若按正确装置进行实验,测得如下数据。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_____________。
(4)CO2和SO2均为酸性气体,性质相似。为了比较亚硫酸和碳酸的酸性强弱,某同学用如下装置进行实验。
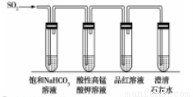
①写出该实验能达到实验目的的实验现象____________。
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸,实验方案为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com