
【题目】I.根据所学知识,回答下列问题:
(1)元素周期表1~20号元素中,金属性最强的元素是______(填元素符号,下同);属于稀有气体的是_________;非金属性最强的元素在周期表中的位置是__________________。
(2)己知NO2和N2O4之间发生可逆反应:2NO2(g)(红棕色)![]() N2O4(g)(无色)。将装有NO2和N2O4混合气体的烧瓶浸入热水中,观察到的现象是_______,产生该现象的原因是________。
N2O4(g)(无色)。将装有NO2和N2O4混合气体的烧瓶浸入热水中,观察到的现象是_______,产生该现象的原因是________。
(3)一定条件下,向2L恒容密闭容器中按体积比1:3充入4.48L(标准状况)N2和H2的混合气体,发生反应N2(g)+3H2(g)![]() 2NH3(g),5min时反应达到平衡状态,测得c(N2)=0.02mol/L。
2NH3(g),5min时反应达到平衡状态,测得c(N2)=0.02mol/L。
①0~5min内,v(NH3)=_______________。
②下列叙述可证明上述反应达到平衡状态的是________(填序号)。
a.V(H2)=3v(N2)
b.容器内压强保持不变
c.每消耗ImolN2,同时生成2molNH3
d.N2、H2和NH3的物质的量浓度不再变化
II.五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。回答下列问题:
(1)五种元素中,原子半径最大的是______(填元素名称),非金属性最强元素的是_________。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是_____(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为______,其中存在的化学键类型为______________。
(4)E离子的结构示意图是____________;元素D最高价氧化物的水化物的化学式为_____。
(5)单质E与水反应的离子方程式为__________________。
【答案】 K He、Ne、Ar 第二周期第ⅦA族 气体颜色加深或红棕色加深 存在平衡2NO2![]() N2O4,加热,平衡发生逆向移动,NO2浓度增大,颜色变深 0.002mol/(L·min) b、d 钠 氯 PH3
N2O4,加热,平衡发生逆向移动,NO2浓度增大,颜色变深 0.002mol/(L·min) b、d 钠 氯 PH3 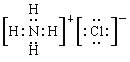 离子键和共价键
离子键和共价键 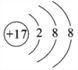 H3PO4或HPO3 C12+H2O=H++Cl-+HC1O
H3PO4或HPO3 C12+H2O=H++Cl-+HC1O
【解析】I、(1)根据元素周期律可知元素周期表1~20号元素中,金属性最强的元素是K;属于稀有气体的是He、Ne、Ar;非金属性最强的元素是F,原子序数是9,在周期表中的位置是第二周期第ⅦA族。(2)由于体系中存在平衡2NO2![]() N2O4,加热,平衡发生逆向移动,NO2浓度增大,因此颜色变深,即将装有NO2和N2O4混合气体的烧瓶浸入热水中,观察到的现象是气体颜色加深;(3)①反应前氮气和氢气的物质的量之和是0.2mol,因此氮气是0.05mol,氢气是0.15mol,3min时反应达到平衡状态,测得c(N2)=0.02mol/L,即剩余氮气是0.04mol,所以消耗氮气是0.01mol,则生成氨气是0.02mol,浓度是0.01mol/L,所以0~5min内,v(NH3)=0.01mol/L÷5min=0.002mol/(L·min)。②a.V(H2)=3v(N2)中没有指明反应的方向,不能说明达到平衡状态,a错误;b.正反应体积减小,因此容器内压强保持不变时说明反应达到平衡状态,b正确;c.每消耗ImolN2,同时生成2molNH3均表示正反应速率,不能说明达到平衡状态,c错误;d.N2、H2和NH3的物质的量浓度不再变化说明反应达到平衡状态,d正确,答案选bd;
N2O4,加热,平衡发生逆向移动,NO2浓度增大,因此颜色变深,即将装有NO2和N2O4混合气体的烧瓶浸入热水中,观察到的现象是气体颜色加深;(3)①反应前氮气和氢气的物质的量之和是0.2mol,因此氮气是0.05mol,氢气是0.15mol,3min时反应达到平衡状态,测得c(N2)=0.02mol/L,即剩余氮气是0.04mol,所以消耗氮气是0.01mol,则生成氨气是0.02mol,浓度是0.01mol/L,所以0~5min内,v(NH3)=0.01mol/L÷5min=0.002mol/(L·min)。②a.V(H2)=3v(N2)中没有指明反应的方向,不能说明达到平衡状态,a错误;b.正反应体积减小,因此容器内压强保持不变时说明反应达到平衡状态,b正确;c.每消耗ImolN2,同时生成2molNH3均表示正反应速率,不能说明达到平衡状态,c错误;d.N2、H2和NH3的物质的量浓度不再变化说明反应达到平衡状态,d正确,答案选bd;
II、五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,该化合物应该是氨气,则A是H,B是N,C是Na,D是P,C和E形成的化合物中阴阳离子的个数比为1:1,则E是Cl。
(1)根据以上分析可知五种元素中,原子半径最大的是钠,非金属性最强元素的是氯。(2)非金属性越强,氢化物越稳定,非金属性是Cl>N>P,所以氢化物稳定性最差的是PH3;(3)元素A和E形成的化合物与元素A和B形成的化合物反应生成氯化铵,电子式为 ,其中存在的化学键类型为离子键和共价键。(4)氯离子的结构示意图是
,其中存在的化学键类型为离子键和共价键。(4)氯离子的结构示意图是 ;磷元素最高价氧化物的水化物的化学式为H3PO4或HPO3。(5)氯气与水反应的离子方程式为C12+H2O=H++Cl-+HC1O。
;磷元素最高价氧化物的水化物的化学式为H3PO4或HPO3。(5)氯气与水反应的离子方程式为C12+H2O=H++Cl-+HC1O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 将Cl2通入氯化亚铁溶液:Fe2++Cl2![]() Fe3++2Cl-
Fe3++2Cl-
B. 氯气通入水中:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. FeCl3溶液中通入过量的氨水: Fe3++3OH-![]() Fe(OH)3↓
Fe(OH)3↓
D. Cl2通入烧碱溶液中:Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)十2H2O![]() 2 Ni(OH)2+ Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是____________________,负极的反应式是_________________。
2 Ni(OH)2+ Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是____________________,负极的反应式是_________________。
(2)一种熔融碳酸盐燃料电池原理示意如图: 电池工作时,外电路上电流的方向应从电极___(“填A或B”)流向用电器。内电路中,CO32-向电极_____(“填A或B”)移动,电极A上CO参与的电极反应为______________________。
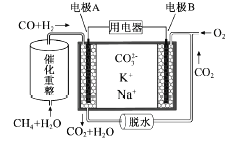
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的电极是原电池的____极,该极的电极反应式是____________________,电池工作时的总反应的离子方程式是__________________。如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为___________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图1为实验室制取氨气的实验装置。

(1)写出A中所发生反应的化学方程式_______________________。要收集干燥的氨气,可以用____________________作干燥剂。
(2)在收集氨气时试管口棉花的作用是___________。
(3)一位学生用制得的氨气,按图2装置进行喷泉实验,烧瓶已充满干燥的氨气,引发喷泉实验的操作是___________。
(4)另一学生积极思考产生喷泉的其他方法,设计了图3装置。首先在锥形瓶中分别加入足量的下列物质,反应后能产生喷泉的是___________。
A.CaCO3粉末和浓盐酸 B.NH4HCO3溶液与稀NaOH溶液
C.HCl和AgNO3溶液 D.HCl和无色酚酞溶液
该同学又向锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是___。
A.硝酸铵 B.食盐 C.浓硫酸 D.硫酸铜
(5)检验氨气已充满试管B的方法是______________.
(6)如制得标准状况下的氨气2.24L,则反应中至少需要熟石灰______g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是
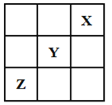
A. Y的氢化物稳定性大于Z的氢化物稳定性
B. Z一定是活泼的金属元素
C. Y的最高价氧化物的水化物是一种强酸
D. 1molX的单质可以跟足量水反应,转移的电子为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( ) 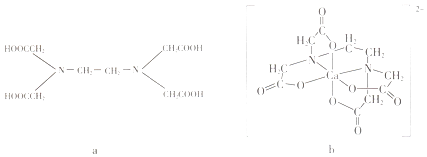
A.b含有分子内氢键
B.b中Ca2+的配位数为4
C.b含有共价键、离子键和配位键
D.a和b中的N原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上按下列路线合成结构简式为的物质 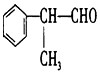 ,该物质是一种香料.
,该物质是一种香料. 
请根据上述路线,回答下列问题:
(1)A的结构简式可能为:;
(2)反应①、③、⑤的反应类型分别为、、;
(3)写出下列反应④、⑥的化学方程式为(要求:有机物写结构简式,并注明反应条件): ④;⑥ .
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化D的方法,其原因是 .
(5)这种香料具有多种同分异构体,其中某些物质有下列特征: ①该物质的水溶液遇FeCl3溶液呈紫色;
②分子中有苯环,且苯环上的一溴代物有两种.
写出符号上述条件的物质可能的结构简式(只写两种): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是:
A. 摩尔是物质的量的单位,毎摩尔物质含有6.02×1023个分子
B. 1 mol氧的质量为16 g
C. 0.5 mol氦气约含有6.02×1023个电子
D. 2H既可表示2个氢原子又可表示2 mol氢分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成下列各题:
(1)在标准状况下,气体A的密度为3.17gL﹣1 , 则气体A的摩尔质量为;
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入某种物质M的饱和溶液,继续煮沸可制得一种红褐色胶体. ①物质M的名称为 .
②下列关于M的水溶液和上述操作所得胶体的叙述,正确的是
A.M的水溶液是电中性的,所得胶体是带电的
B.二者分散质的粒子都不能透过半透膜
C.二者可用丁达尔效应区别
D.向两者中逐滴滴加盐酸溶液均无明显现象
若胶体中含有杂质M则可用法提纯此分散系.
(3)同温同压下,同体积的CO2和CO,它们的分子数之比为 , 物质的量之比为 , 密度之比为 .
(4)V L硫酸铝溶液中含有m gAl3+ , 则溶液中SO42﹣的物质的量浓度是molL﹣1 , 硫酸铝的物质的量浓度是molL﹣1
(5)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g.此混合物中CO和CO2的物质的量比是 , CO的体积分数是 , C和O的原子个数比是 .
(6)3.01×1023个OH﹣的质量为 , 含有电子的物质的量为 , 和克Na+含有的离子数相同.
(7)欲除去粗盐中的Ca2+ , Mg2+ , SO42﹣等杂志,溶解后可依次加入、、 , 过滤出沉淀后再加入 , 蒸发结晶即可.(填写化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com