将10g铁粉置于40mlHNO3溶液中,微热,反应过程中随着HNO3浓度的降低生成气体的颜色由红棕色变为无色(只考虑NO).充分反应后,溶液中还残留4.4g固体,且产生的混合气体恰好可用100ml 1.5mol?L-1的NaOH溶液处理完全.
(1)求该反应中被还原和未被还原的HNO3的物质的量之比.
(2)求原HNO3溶液物质的量浓度.
(3)求NO、NO2体积比.
【答案】
分析:将10g铁粉置于40mlHNO
3溶液中,发生的反应有:Fe+6HNO
3(浓)
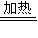
Fe(NO
3)
3+3NO
2↑+3H
2O,3Fe+8HNO
3(稀)=3Fe(NO
3)
2+2NO↑+4H
2O,
反应后铁过量,则继续发生:2Fe
3++Fe=3Fe
2+,最后得到溶液为Fe(NO
3)
2,
反应的铁的质量为:10g-4.4g-5.6g,参加反应的NaOH的物质的量为0.1L×1.5mol/L=0.15mol,根据反应的有关方程式计算.
解答:解:(1)反应的铁的质量为:10g-4.4g-5.6g,则n(Fe)=
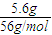
=0.1mol,
将10g铁粉置于40mlHNO
3溶液中,发生的反应有:Fe+6HNO
3(浓)
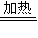
Fe(NO
3)
3+3NO
2↑+3H
2O,
3Fe+8HNO
3(稀)=3Fe(NO
3)
2+NO↑+4H
2O,反应后铁过量,则继续发生:2Fe
3++Fe=3Fe
2+,最后得到溶液为Fe(NO
3)
2,
所以,未被还原的HNO
3的物质的量为n(HNO
3)=2n(Fe)=2×0.1mol=0.2mol,
参加反应的NaOH的物质的量为0.1L×1.5mol/L=0.15mol,与反应生成的气体生成NaNO
2,
则被还原的硝酸的物质的量为:n(HNO
3)=n(NaOH)=0.15mol,
所以该反应中被还原和未被还原的HNO
3的物质的量之比为:0.15mol:0.2mol=3:4,
答:该反应中被还原和未被还原的HNO
3的物质的量之比为3:4;
(2)40mlHNO
3溶液中n(HNO
3)=0.15mol+0.2mol=0.35mol,
则:c(HNO
3)=
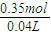
=8.75mol/L,
答:原HNO
3溶液物质的量浓度为8.75 mol/L;
(3)设混合气体中NO为xmol,NO
2为ymol,
则有:
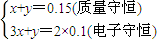
解之得:
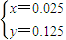
相同条件下,气体的物质的量之比等于体积之比:则
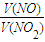
=
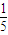
,
答:NO、NO
2体积比为1:5.
点评:本题考查化学方程式的有关计算,题目难度不大,注意有关反应方程式的书写,从守恒的角度解答.

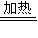 Fe(NO3)3+3NO2↑+3H2O,3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,
Fe(NO3)3+3NO2↑+3H2O,3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,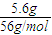 =0.1mol,
=0.1mol,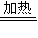 Fe(NO3)3+3NO2↑+3H2O,
Fe(NO3)3+3NO2↑+3H2O,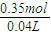 =8.75mol/L,
=8.75mol/L,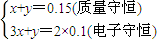
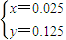
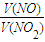 =
=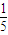 ,
,
