
已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断正确的是
A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体, c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20mL0.01mol/L氨水中的Ksp比在20mL0.01mol/LNH4Cl溶液中的Ksp小
D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后Mg(OH)2不可能转化为MgF2
科目:高中化学 来源:2015-2016学年江西省高二上第一次月考化学试卷(解析版) 题型:选择题
下列图示与对应叙述相符合的是

A.图I:反应H2+I2 2HI 达平衡后,升高温度时反应速率随时间的变化
2HI 达平衡后,升高温度时反应速率随时间的变化
B.图Ⅱ:反应2SO2+O2 2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化
2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化
C.图III:反应N2+3H 2 2NH3 在恒温情况下,反应速率与压强的关系
2NH3 在恒温情况下,反应速率与压强的关系
D.图IV:反应CO2(g)+H2(g)  CO(g)+H2O(g) ΔH>0,水蒸气含量随时间的变化
CO(g)+H2O(g) ΔH>0,水蒸气含量随时间的变化
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期质量监测化学试卷(解析版) 题型:填空题
(14分) 氮元素能形成多种多样的化合物。请回答:
(1)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
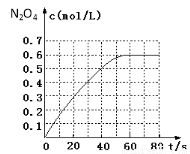
①298k时,该反应的平衡常数为 L·mol-1(精确到0.01);
②下列情况不能用来判断该反应是否处于平衡状态的是 ;
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.混合气体的气体压强保持不变
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填 “>”、“<”或“=”)。
(2)常温条件下,向100 mL 0.1mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如下图所示。试分析图中a、b、c、d、e五个点(该条件下硫酸第二步电离是完全的)。
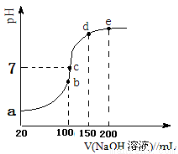
①a点溶液的pH_________1(填“>”“<”或“=”);
②b点溶液中发生水解反应的离子是____________;
③c点溶液中各离子浓度由大到小的排列顺序为 ;
④d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月联考化学试卷(解析版) 题型:选择题
若在铜片上镀银时,下列叙述正确的是
① 将铜片接在电池的正极上
② 将银片接在电源的正极上
③ 需用CuSO4溶液作电解液
④ 在银片上发生的反应是:4OH–- 4e–=O2↑+ 2H2O
⑤ 需用AgNO3溶液作电解液
⑥ 在铜片上发生的反应是:Ag+ + e- = Ag
A.①③⑥ B.②③④⑥ C.①④⑤⑥ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:选择题
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A、HA为强酸
B、该混合液pH=7
C、图中X表示HA,Y表示OH-,Z表示H+
D、该混合溶液中:c(A-)+ c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体__________g。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验。
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1): 。
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:已知:反应后混合溶液的比热容c=4.2×10—3 kJ/(g·℃)
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ℃ |
2 | 25.9 | 25.9 | 25.9 | 29.8 | |
3 | 26.4 | 26.2 | 26.3 | 30.4 | |
②用上述实验数值计算中和热 kJ·mol-1(小数点后保留两位数字)。
③能引起中和热偏高的原因是 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:选择题
已知反应:①101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ·mol-1
下列结论正确的是
A.碳的燃烧热大于110.5 kJ·mol-1
B.2C(g)+O2(g)===2CO(g) ΔH>-221 kJ·mol-1
C.98%的浓硫酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ·mol-1
D.稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期10月月考化学试卷(解析版) 题型:选择题
CO(g)+NO2(g) CO2(g)+NO(g)△H<0,若其他条件不变,只改变下列条件,能使混合气体颜色变深的是
CO2(g)+NO(g)△H<0,若其他条件不变,只改变下列条件,能使混合气体颜色变深的是
A.降低温度 B.使用催化剂
C.增大CO的浓度 D.增大压强
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期返校联考化学试卷(解析版) 题型:选择题
下列关于金属腐蚀的叙述正确的是
A.金属(M表示金属) 被腐蚀的本质是: M n+ + ne- = M
B.金属不可能在碱性环境中发生电化学腐蚀
C.镀锌铁的镀层破损后,镀层仍能对铁起保护作用
D.钢管与外加直流电源的正极相连,以保护它不受腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com