
【题目】X、Y混合气体在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
A.平衡向右移动 B.a+b>c
C.Y的转化率提高 D.Z的体积分数增加
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应C(石墨)=C(金刚石)是吸热反应,下列说法中不正确的( )
A.金刚石和石墨是不同的单质B.金刚石和石墨可以相互转化
C.石墨比金刚石更稳定D.相同质量的石墨比金刚石的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 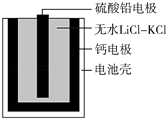
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C.反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值,下列说法正确的是( )
A.1L 1 molL﹣1的Na2CO3 溶液中含有的阴离子数目大于NA
B.标准状况下,2.24LCCl4中含有共价键总数为0.4NA
C.常温常压下,18g D2O的原子总数为3NA
D.7.1g Cl2与足量的Fe反应,转移电子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组可用同种方法除去杂质(括号内物质)的是
A.植物油(水)与 乙醇(水)
B.蛋白质溶液(NaCl)与淀粉溶液(KI)
C.泥水(淀粉溶液)与 Fe(OH)3胶体(FeCl3)
D.氧化钙(碳酸钙)与 NaHCO3(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究铁及其化合物对于工业生产具有重要意义.
(1)Fe2(SO4)3和明矾一样也具有净水作用,其净水的原理是(用离子方程式表示).
(2)高铁酸钾(K2FeO4)是一种新型的水处理剂.已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如图1所示: 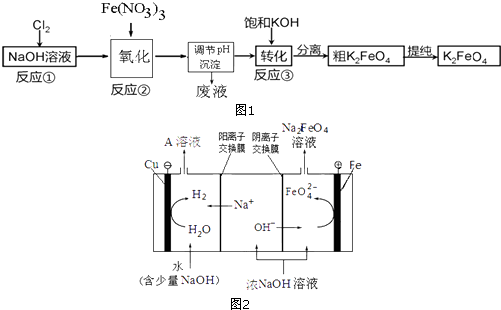
①反应②氧化过程所发生反应的离子方程式是: , 在生产中一般控制反应温度30℃以下,其原因是: .
②反应③中加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明 .
③在提纯K2FeO4中采用重结晶、过滤、洗涤、低温烘干的方法,洗涤滤渣的方法是 .
④若某温度下,将Cl2通入NaOH溶液中得到NaCl、NaClO、NaClO3的混合溶液,经测定溶液中ClO﹣与ClO3﹣的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 .
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4 , 其工作原理如图2所示:阳极的电极反应式为;其中可循环使用的物质是 . (填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
选项 | ①中物质 | ②中物质 | 预测中的现象 |
A | 稀盐酸 | 碳酸钠、氢氧化钠混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列题
(1)I. 4g CO 在氧气中燃烧生成 CO2,放出 9.6kJ 热量,写出 CO 燃烧的热化学方程式;
(2)已知拆开 1mol H﹣H 键、1mol N﹣H 键、1mol N≡N 键分别需要的能量是 436kJ、391kJ、946kJ,则 N2与 H2反应生成 NH3 的热化学方程式为 .
(3)已知碳的燃烧热△H1=a kJmol﹣1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H2=b kJmol﹣1
S(s)+2K(s)═K2S(s)△H3=c kJmol﹣1
则 S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=
(4)II.稀土元素是宝贵的战略资源,赣州的稀土蕴藏量居世界首位,是名符其实的稀土王国. (4)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下 CeCl3易发生水解,无水 CeCl3可用加热 CeCl36H2O 和 NH4Cl 固体混合物的方法来制备.其中 NH4Cl 的作用是
(5)在某强酸性混合稀土溶液中加入 H2O2 , 调节 pH≈3,Ce3+通过下列反应形成 Ce(OH)4 沉淀得以分离.完成反应的离子方程式:
Ce3++H2O2+H2O═Ce(OH)4↓+ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com