
如何鉴别NO2与溴蒸气?
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
现有如下两个反应:
A.NaOH + HCl = NaCl + H2O
B.2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质,能设计成原电池的是:__________(选择“A”或“B”) (1分);
(2)如果可以, 写出负极电极反应式:_______________,电解质溶液:____________;
(3)由第(2)小题可知:一个完整有氧化还原反应方程式可拆写成两个“半反应式”,一个是氧化反应式,一个是还原反应式,并由此实现了化学能与电能的相互转化;则3NO2+H2O = 2H++2NO3-+NO反应的氧化反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
钛被称为“21世纪金属”,是研制卫星、火箭、宇宙飞船及深海潜艇的重要材料。研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置模拟获得金属钙(需定期更换石墨棒),并以钙为还原剂,还原二氧化钛制备金属钛。下列叙述正确的是( )
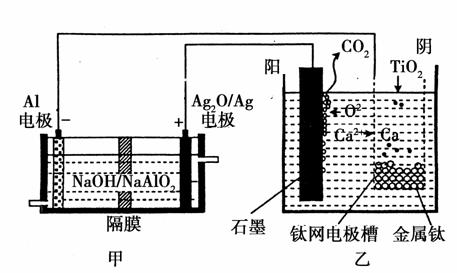
A.甲装置工作过程中OH-向Ag2O/Ag极移动,乙装置工作过程中O2-向阴极移动
B.若电解金属Ti效率为η,则制备1 mol Ti时消耗Al的物质的量为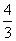 (1-η) mol
(1-η) mol
C.乙装置阳极的电极反应式为C+2O2--4e-===CO2↑
D.在制备金属钛前后,整套装置中CaO的总量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温同压下,下列反应的焓变和平衡常数分别表示为
(1)2SO2(g)+O2(g)2SO3(g)
ΔH1=-197 kJ·mol-1 K1=a
(2)2NO(g)+O2(g)2NO2(g)
ΔH2=-144 kJ·mol-1 K2=b
(3)NO2(g)+SO2(g)SO3(g)+NO(g)
ΔH3=-m kJ·mol-1 K3 =c
下列说法正确的是( )
A.m=53 c2=a/b B.m=-26.5 2c=a-b
C.m=-170.5 2c=a-b D.m=26.5 c2=a/b
查看答案和解析>>
科目:高中化学 来源: 题型:
某可逆反应X(g)+Y(g)Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:
| T/℃ | 700 | 800 | 850 | 1000 |
| K | 0.01 | 0.05 | 0.10 | 0.40 |
(1)上述反应的平衡常数表达式K=________,ΔH________0(填“>”或“<”)。加入催化剂,该反应的ΔH将________(填“增大”、“减小”或“不变”)。
(2)若上述反应在绝热恒容的密闭容器内进行,则能说明该反应达到化学平衡状态的依据有________。
A.混合气体的密度保持不变
B.v正(X)=v正(Z)
C.容器内温度恒定
D.W的质量分数不变
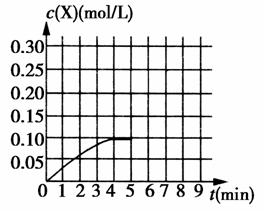
(3)在850 ℃、体积为1 L的密闭容器内,加入0.2 mol Z和0.3 mol W发生上述反应。X的c(X)-t曲线如图所示。
①0~4 min内W的平均速率为________mol·L-1·min-1。
②在5 min末将容器体积缩小至0.5 L,若在8 min末达到新平衡(此时X的浓度约为0.26 mol/L),请在图中画出5 min~9 min的X浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并
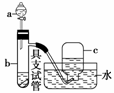 观察还原产物的实验装置。
观察还原产物的实验装置。
Ⅰ.浓硝酸的强氧化性实验
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管中放入约2 mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式:______________________________________
________________________________________________________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象
________________________________________________________________________
________________________________________________________________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是________________________________________________________________________
________________________________________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是______________________________
(填写序号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是________________________________________________________________________
________________________________________________________________________。
Ⅳ.问题讨论
用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:____________________。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:____________________________________________________________
________________________________________________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是_______________________________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 室温下,测定等浓度的CH3COOH溶液和盐酸的pH | 比较两种酸的酸性强弱 |
| B | CH3CH2Br 中加入NaOH溶液加热充分反应,取上层水溶液加入AgNO3溶液 | 检验CH3CH2Br中的溴原子 |
| C | 向25ml沸水中滴加4—5滴饱和FeCl3溶液,加热至有红褐色沉淀产生 | 制备Fe(OH)3胶体 |
| D | 在某溶液中先加入HNO3溶液,再加入Ba(NO3)2溶液 | 检验溶液中是否存在SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com