
| A、100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
| B、25℃时,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| C、25℃时,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| D、100℃时某溶液中由水电离产生的c(H+)=1×10-11mol?L-1,则该溶液的pH可能是11或3 |


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
| A、氯化钠溶液中滴入硝酸银溶液 |
| B、铁片置于硫酸铜溶液中 |
| C、氢气在氯气中燃烧 |
| D、二氧化碳通入澄清石灰水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可逆反应的特征是正反应速率和逆反应速率相等 |
| B、对已达到化学平衡的反应仅改变浓度,若平衡移动,则平衡常数(K)一定不变 |
| C、电镀时应把镀件置放电解槽的阳极 |
| D、电解AlCl3来制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 水解 |
| O2 |
| Cu |
| 银氨溶液 |
| 微热 |
| A、CH3Cl |
| B、CH3CH2Br |
| C、CH3CHBrCH3 |
D、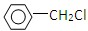 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制乙烯:C2H2+H2→C2H4 | ||
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||
| C、乙醇和钠反应:CH3CH2OH+Na→CH3CH2ONa+2H2↑ | ||
D、实验室用液溴和苯在催化剂作用下制溴苯: +Br2 +Br2
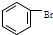 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com