
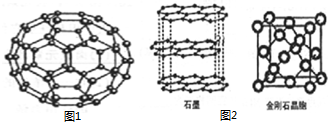
 C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.
C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.分析 (1)C60单质为分子晶体,微粒之间的作用力为分子间作用力;
(2)根据价层电子对互斥理论判断C原子杂化类型,石墨中的碳原子与相邻的三个碳原子以σ键结合;石墨熔化时除了克服共价键以外,还要克服范德华力;
(3)金刚石晶胞中碳原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$;根据硬球接触模型,正方体对角线的$\frac{1}{4}$就是C-C键的键长,据此计算原子半径.
解答 解:(1)C60单质为分子晶体,微粒之间的作用力为分子间作用力,
故答案为:分子间作用力;
(2)石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构,碳原子的杂化类型为sp2杂化,金刚石中碳碳键和石墨中碳碳键都是C-C共价键,金刚石熔化破坏共价键,石墨熔化时除了克服共价键以外,还要克服范德华力,所以相同条件下石墨的熔点应高于金刚石,
故答案为:sp2;>;
(3)金刚石晶胞中碳原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8;根据硬球接触模型,正方体对角线的$\frac{1}{4}$就是C-C键的键长,晶胞正方体对角线长度=$\sqrt{3}$a,所以$\frac{1}{4}\sqrt{3}$a=2r,所以r=$\frac{\sqrt{3}}{8}$a,
故答案为:8;$\frac{\sqrt{3}}{8}$.
点评 本题考查晶胞计算、原子杂化、晶体类型判断等知识点,侧重考查分析判断及计算能力,难点是晶胞计算,明确金刚石中C-C键键长与棱长关系是解(3)题关键,题目难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
 氨气在工农业生产中有非常重要的应用.
氨气在工农业生产中有非常重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| B. | 气体单质中一定有σ键,可能有π键 | |
| C. | 乙烯与氢气发生加成反应时,乙烯分子中有π键断裂 | |
| D. | 当原子形成分子时,首先形成σ键,可能形成π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
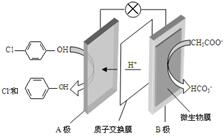 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为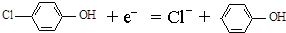 | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| D. | B极为电池的正极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
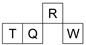 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 原子半径:T>Q>R | |
| C. | 最高价氧化物对应水化物的酸性:Q<W | |
| D. | 含T元素的盐溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某同学研究铜与浓硫酸的反应装置:
如图是某同学研究铜与浓硫酸的反应装置:| 实验装置 | 实验现象 |
 | 品红褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com