
能源是当今社会发展的三大支柱之一。有专家提出:如果能够利用太阳能使
燃烧产物,如CO2、H2O、N2等重新组合(如右图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为
A. 化学能 B. 热能
C. 生物能 D. 电能

科目:高中化学 来源: 题型:
下列说法正确的是
A.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H相同
B.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
C.已知:①2H2(g) +O2(g) =2H2O(g) △H=-a kJ·mol-1,②2H2(g)+O2 (g)= 2H2O(1) △H=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2 (g)=CO2(g) △H=- 393.5kJ·mol-1,②C(s,金刚石)+O2(g)=CO2 (g) △H=- 395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) △H= -1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.80mL 10mol 浓盐酸与足量MnO2反应,转移电子数为0.4NA
浓盐酸与足量MnO2反应,转移电子数为0.4NA
B.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
C.1 mol A13+含有核外电子数为3NA
D.常温下,16g CH4中共用电子对的数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
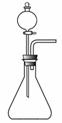 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:
2 NH3(g)+CO2(g)  NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 )
如用右图装置制取氨气,你所选择的试剂是 。
制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化
碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
发生器用冰水冷却的原因是___________ __ _。
液体石蜡鼓泡瓶的作用是__________________________________________________。
从反应后的混合物中分离出产品的实验方法是_______(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
 尾气处理装置如右图所示。双通玻璃管的作用:________ ;
尾气处理装置如右图所示。双通玻璃管的作用:________ ;
浓硫酸的作用: 、______________、 _。
取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水
充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量
为1.000 g。则样品中氨基甲酸铵的物质的量分数为___________。
(精确到2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
对某一可逆反应来说,使用催化剂的作用是
A.提高反应物的平衡转化率 B.改变反应的ΔH.
C.增大正反应速率,减小逆反应速率 D.以同样程度改变正逆反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应:m A(g) + n B(g)  x C(g),在不同温度及压强(p1, p2)条件下,反 应物A的转化率如图所示,下列判断正确的是
x C(g),在不同温度及压强(p1, p2)条件下,反 应物A的转化率如图所示,下列判断正确的是

A.△H > 0, m + n > x B.△H > 0, m + n < x
C.△H < 0, m + n < x D.△H < 0, m + n > x
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.80mL 10mol 浓盐酸与足量MnO2反应,转移电子数为0.4NA
浓盐酸与足量MnO2反应,转移电子数为0.4NA
B.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
C.1 mol A13+含有核外电子数为3NA
D.常温下,16g CH4中共用电子对的数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:

下列叙述不正确的是
A. 放电时负极反应为:Zn - 2e— + 2OH— == Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3 -3e— + 5OH— == FeO42— + 4H2O
C. 放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com