
下列说法正确的是( )
|
| A. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 |
|
| B. | NH4HCO3(s) |
|
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可单独作为反应自发性的判据 |
|
| D. | 在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
| 反应热和焓变. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | A、反应自发与否决定于焓变和熵变两方面因素; B、△H﹣T△S<0的反应能够自发进行; C、反应自发与否决定于焓变和熵变两方面因素; D、催化剂只能影响反应速率,不影响平衡移动. |
| 解答: | 解:A、吸热的熵增大的反应高温下也能够自发进行,故A错误; B、△H>0,若使△H﹣T△S<0必须△S>0,故B正确; C、反应自发与否决定于焓变和熵变两方面因素,故C错误; D、催化剂只能影响反应速率,不影响平衡移动,所以催化剂不能改变反应方向,故D错误; 故选B. |
| 点评: | 本题考查了反应自发进行的条件,注意利用△H﹣T△S进行判断,题目难度不大. |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的
是( )
A.0.1 mol·L-1NaOH溶液:K+、Na+、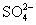 、
、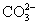
B.0.1 mol·L-1Na2CO3溶液:K+、Ba2+、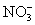 、Cl-
、Cl-
C.0.1 mol·L-1FeCl3溶液:K+、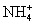 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)= 1×1014的溶液:Ca2+、Na+、ClO-、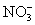
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )
|
| A. | 溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
|
| B. | 合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施 |
|
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
|
| D. | 对于2HI(g)═H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置进行下列实验,实验结果与预测现象不一致的是

| 选项 | 中物质 | ②中物质 | 预测①中现象 |
| A | 酚酞溶液 | 浓氨水 | 无色变红色 |
| B | 湿润红布条 | 饱和氯水 | 红布条褪色 |
| C | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
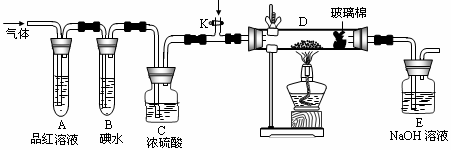
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒,当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙 E.双氧水 F.硝酸银
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)⇌xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

|
| A. | 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) |
|
| B. | 若x>3,达到平衡后B的转化率关系为:α(M)>α(N) |
|
| C. | 若x<3,C的平衡浓度关系为:c(M)>c(N) |
|
| D. | x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生反应:2A(g)+2B(g)⇌xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L•min),下列说法正确的是( )
|
| A. | A和B的转化率均是20% |
|
| B. | x=4 |
|
| C. | 平衡时A的物质的量为2.8mol |
|
| D. | 平衡时气体压强比原来减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下面三个数据:①7.2×10-4 ②4.6×10-4 ③4.9×10-10,分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:NaCN+HNO2===HCN+NaNO2;NaCN+HF===HCN+NaF;NaNO2+HF===HNO2+NaF。由此可判断下列叙述中,正确的是( )
A.HF的电离平衡常数是①
B.HNO2的电离平衡常数是①
C.HCN的电离平衡常数是②
D.HNO2的电离平衡常数是③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.CHCl3是正四面体形
B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形
C.二氧化碳中碳原子为sp杂化,为直线形分子
D.NH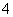 是三角锥形
是三角锥形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com