
【题目】SiO2是一种化工原料,可以制备一系列物质。下列说法正确的是
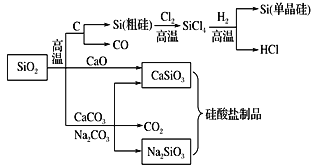
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、黏土和石英制成的,具有固定的熔点
【答案】C
【解析】
A.化学反应前后有元素化合价变化的一定是氧化还原反应;
B.光导纤维的成分是二氧化硅;
C.二氧化硅和盐酸不反应,碳酸钙溶于盐酸;
D.玻璃属于混合物,没有个固定的熔点。
A.化学反应前后有元素化合价变化的一定是氧化还原反应,二氧化硅与碳反应生成硅单质的反应有元素化合价的变化,属于氧化还原反应,A错误;
B.光导纤维的成分是二氧化硅,不是硅酸盐,B错误;
C.碳酸钙溶于盐酸生成氯化钙和水以及二氧化碳,二氧化硅和盐酸不反应,可以用盐酸除去石英(主要成分为SiO2)中混有的少量碳酸钙,C正确;
D.玻璃是由纯碱、石灰石和石英制成的,玻璃属于混合物,没有固定的熔点,D错误;
故合理选项是C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
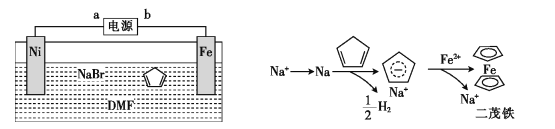
A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为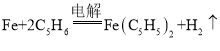
D.二茂铁制备过程中阴极的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氣乙烯进行水体修复,修复过程如图所示。H+、O2、![]() 等共存物的存在会影响水体修复效果。下列说法错误的是
等共存物的存在会影响水体修复效果。下列说法错误的是
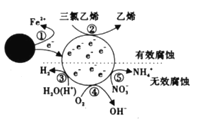
A.反应①在负极发生,反应②③④⑤在正极发生
B.增大单位体积水体中小粒径ZVI的投入量,可加快水体修复速率
C.水体修复过程中,三氯乙烯每脱去3mol Cl,就有3molFe变成Fe2+
D.⑤的电极反应式为![]() + 10H++8e-==
+ 10H++8e-==![]() +3H2O
+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni(OH)2作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备,工艺流程如图所示。回答下列问题:

(1)“滤渣1”的成分为______(写化学式)。
(2)“除铁”中,加入NaClO的目的是_________________,为了证明加入NaClO已足量,可选择的试剂是__________ (填字母标号)。
a.KSCN溶液、氯水 b.K3[Fe(CN)6]溶液 c.NaOH溶液
(3)已知“滤渣2”的成分为黄钠铁矾,其化学式为NaFe3(SO4)2(OH)6,则“除铁”
中“Na2CO3/△”条件下生成滤渣2的离子方程式为_______________。
(4)“除镁”中,若溶液pH过小,Mg2+沉淀不完全,原因是_____________。
(5)“沉镍”的离子方程式为__________。
(6)以镍钴锰三元材料(可简写为Li1-nMO2)为一极电极材料的新型锂电池工作原理如图所示,放电时总反应为Li1-nMO2+LinC6 ![]() LiMO2+6C,则充电时b极的电极反应式为____________________。
LiMO2+6C,则充电时b极的电极反应式为____________________。
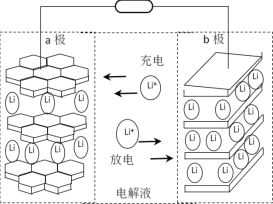
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做“FeSO4被HNO3氧化”的实验,发现溶液变深棕色。猜想可能是生成的NO2或NO与Fe2+或Fe3+反应,使溶液变为深棕色,设计下列装置探究。下列说法错误的是
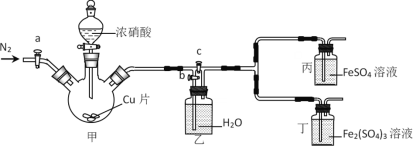
A.先检查装置气密性,加入药品后,关闭c,打开a和b,再通入一段时间N2
B.关闭a、c,打开b及分液漏斗活塞,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO与Fe2+反应
C.甲中反应一段时间后,更新丙、丁中试剂,关闭a和b,打开c,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO2也可与Fe2+反应
D.该实验的缺陷是缺少尾气吸收装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.1molCl2与足量铁反应,转移电子数为2NA
B.3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
C.65gZn与适量浓硫酸完全反应所得混合气体的分子数为NA
D.1L0.1 mol/L 盐酸中含H+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。请回答下列问题。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,A中碱石灰的作用是_______。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_______。
⑤打开活塞K1,缓缓鼓入空气数分钟,拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)实验方案的评价及数据处理
①实验步骤⑤打开活塞K1,缓缓鼓入空气数分钟的目的是__________。
②若样品质量为W g,反应后C装置增加的质量为m1 g则D装置增重的质量为______g(用含m1的代数式表达),混合物中NaHCO3的质量分数为________(用含W、m1的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二烯烃与溴反应制备多卤代物,反应的区域选择性在有机合成中具有重要意义。1,3–丁二烯(g) (CH2=CH—CH=CH2)和Br2(g)反应原理如下:
①CH2=CH-CH=CH2(g)+Br2(g)→![]() (g) △H1=akJ·mol-1
(g) △H1=akJ·mol-1
②CH2=CH-CH=CH2(g)+Br2(g)→ (g) △H2=bkJ·mol-1
(g) △H2=bkJ·mol-1
③![]() (g)
(g) (g) △H3
(g) △H3
回答下列问题:
(1)△H3=_____________。
(2)1,3-丁二烯和Br2反应的能量随反应过程的变化关系如图所示:

1,3-丁二烯和Br2反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为_________
(3)T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)(CH2=CH-CH=CH2)和Br2(g)各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 |
1,3-丁二烯 | 100% | 72% | 0% | 0% | 0% |
1,2加成产物 | 0% | 26% | 10% | 4% | 4% |
1,4加成产物 | 0% | 2% | 90% | 96% | 96% |
在0 ~20min内,反应体系中1,4-加成产物的平均反应速率v(1,4加成产物)=_______。
(4)对于反应③,若要提高1,4-加成产物 ( )平衡体系中的物质量分数,可以采取的措施有_____
)平衡体系中的物质量分数,可以采取的措施有_____
A.适当升高温度 B.使用合适的催化剂
C.增大体系的压强 D.将1,4加成产物及时从体系分离
(5)反应 1,3-丁二烯二聚体的解聚为可逆反应:
 (g)
(g)![]() 2
2![]() (g) △H>0
(g) △H>0
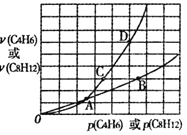
在一定条件下,C4H6和C8H12的消耗速率与各自分压有如下关系:v(C8H12)=k1·p(C8H12),v(C4H6)=k2·p2(C4H6)。相应的速率与其分压关系如图所示,一定温度下k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=_____;在图中标出点(A、B、C、D)中,能表示反应达到平衡状态的点是______ ,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下.11.2L丙烷含有的极性键数目为5NA
B. 7g锂在空气中完全燃烧时转移的电子数为NA
C. 1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D. 常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com