
| 阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
分析 ①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰,说明不含K+;
②若向溶液中加入KSCN溶液,无明显变化,说明原溶液中不含Fe3+;
③向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,气体为NO,可知溶液中含有Fe2+、NO3-,此时溶液依然澄清,且溶液中阴离子种类不变,应原溶液含Cl-,不含CO32-、SiO32-;
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,白色沉淀为BaSO4,则含SO42-,
结合5种离子的物质的量浓度相等,均为0.1mol•L-1,SO42-、Fe2+、NO3-、Cl-中阳离子电荷总数小于阴离子电荷综合,应含+2价阳离子为Mg2+,以此解答该题.
解答 解:(1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+;一定不含的阴离子是CO32-、SiO32-,
故答案为:K+、Fe3+;CO32-、SiO32-;
(2)③中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,④中生成白色沉淀的离子方程式是SO42-+Ba2+=BaSO4↓,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;SO42-+Ba2+=BaSO4↓;
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(4)由上述分析可知,最终确定原溶液中所含阳离子是Fe2+、Mg2+,阴离子是Cl-、NO3-、SO42-,故答案为:Fe2+、Mg2+;Cl-、NO3-、SO42-.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、元素化合物等为解答的关键,侧重分析与推断能力的考查,注意氧化还原反应的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入氯气:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 氨气与盐酸反应:NH3+HCl═NH4++Cl- | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 将稀硝酸滴在铁片上:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ①②④ | C. | ②③ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
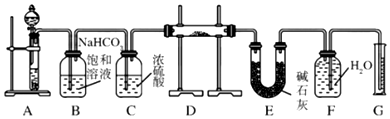
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃600℃1000℃2000℃ |
| 主要成分 | Fe2O3 Fe3O4 FeO Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
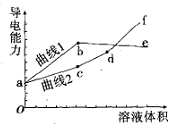 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )| A. | 曲线2 代表滴加NH3•H2O溶液的变化曲线 | |
| B. | b和d点对应的溶液均显碱性 | |
| C. | b点溶液中c(NH4+ )>c(SO42- )>c(H+ )>c(OH- ) | |
| D. | df段导电能力升高的原因是发生了反应Al(OH)3+OH-═[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2 g | B. | 4.8 g | C. | 6.4 g | D. | 10.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl受热易分解,可用于实验室制氨气 | |
| B. | 液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 | |
| C. | NO2气体有毒,且可以和水反应,实验室多余的NO2气体用水吸收即可 | |
| D. | N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2=N2O4与N2O4=2NO2 | |
| B. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI与2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 | |
| C. | CO2+H2O=H2CO3与 H2CO3=CO2↑+H2O | |
| D. | CaO+CO2=CaCO3与CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com