
【题目】某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。回答下列问题:

(1)沉淀A的化学式是__________,滤液B的成分是___________;
(2)步骤④的化学方程式为________________________;
(3)在步骤②中发生的离子反应方程式为(中和反应除外):_________________。
【答案】 SiO2、NaOH、NaCl Na[Al(OH)4] 2A1(OH)3![]() Al2O3+3H2O Fe3++3OH-==Fe (OH)3↓Al3++4OH-=[Al(OH)4]-
Al2O3+3H2O Fe3++3OH-==Fe (OH)3↓Al3++4OH-=[Al(OH)4]-
【解析】由分离流程可知,氧化铝样品中含有氧化铁和二氧化硅杂质,加入过量盐酸,氧化铝与过量盐酸反应生成氯化铝,氧化铁和盐酸反应生成氯化铁,二氧化硅不与盐酸反应,则操作I为过滤,得到沉淀A为SiO2,滤液A中含氯化铝、氯化铁、盐酸,再加入过量NaOH,氯化铝与碱反应生成偏铝酸钠和氯化钠,氯化铁与碱反应生成氢氧化铁沉淀和氯化钠,盐酸与碱反应生成氯化钠,则操作为过滤,得到沉淀B为Fe(OH)3,滤液中有NaAlO2、NaCl、NaOH,再通入过量的二氧化碳,与NaAlO2反应生成Al(OH)3,分解生成氧化铝。
(1)由上述分析可知,沉淀A为SiO2,滤液B为NaAlO2、NaCl、NaOH;(2)步骤④是氢氧化铝分解:2A1(OH)3![]() Al2O3+3H2O;(3)根据以上分析可知步骤②中发生的离子反应方程式为Fe3++3OH-==Fe (OH)3↓、Al3++4OH-=[Al(OH)4]-。
Al2O3+3H2O;(3)根据以上分析可知步骤②中发生的离子反应方程式为Fe3++3OH-==Fe (OH)3↓、Al3++4OH-=[Al(OH)4]-。


科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
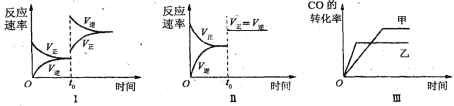
下列分析中不正确的是( )
A.图Ⅰ研究中的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属稼是一种广泛用于电子工业和通讯领域的重要金属,稼元素(31Ga)在元素周期表中位于第四周期,IIIA族,化学性质与铝元素相似。
(1)稼元素的原子结构示意图是_______________________。
(2)工业上利用Ga与NH3高温条件下合成固体半导体材料氮化稼(GaN)同时又有氢气生成。反应中,每生成3molH2时就会放出30.8kJ的热量。
①反应的热化学方程式是________________________;
②反应的化学平衡常数表达式是___________________,温度升高时,反应的平衡常数_____________(填“变大”“变小”或“不变”);[
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是__________
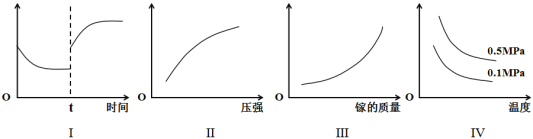
A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.IV图像中纵坐标可以为体系内混合气体平均相对分子质量
(3)工业上提纯镓的方法很多,其中以电解精炼法为多。具体原理如下:以待提纯的粗稼(内含Zn、Fe、Cu杂质)为阳极,以高纯稼为阴极,以NaOH水溶液为电解质溶液。 在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①己知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解精炼镓时阳极泥的成分是________________;
② GaO2-在阴极放电的电极方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质的说法正确的是
A.强电解质一定是离子化合物
B.强电解质、弱电解质的电离都是吸热过程
C.强电解质的饱和溶液一定是浓溶液
D.强电解质在水中一定能全部溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
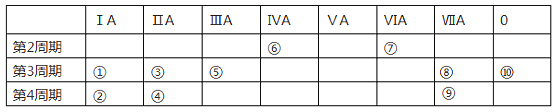
(1)10种元素中,化学性质最不活泼的是________________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是____________。
(4)元素⑦的氢化物常温下和元素⑧的单质反应的化学方程式为:____________。
(5)①和⑨两种元素形成化合物的化学式为_________,该化合物溶液与元素⑧的单质反应的化学方程式为_______________。
(6)已知元素的电负性与元素的化合价一样,也是J已索的一种基本性质。下面给出14种元素的电负性。
元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2 | 1.5 | 2.5 | 2.8 | 4 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,推测元素的电负性的变化规律是:_________,_________。
(2)预测Br与I元素电负性的大小关系_________,前四周期中,电负性最小的元素是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A. 甲装置:可用来证明碳的非金属性比硅强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法不能检查此装置的气密性
D. 丁装置:先从①口进气集满CO2,再从②口进气,可收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是四种短周期元素,乙原子有三个电子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲是 元素(填元素符号),甲的单质与水反应的化学方程式为 ;
(2)乙是 元素(填元素符号),原子结构示意图为 ;
(3)丙是 元素(填元素名称),最高价氧化物对应水化物的化学式是 ;
(4)丁是 元素(填元素名称),甲与丁两种元素可组成的物质有 、 。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com