
【题目】氧和硫属于同主族元素,其单质和化合物在生产生活中用途很广。
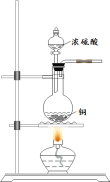
SO2可用于防腐剂、消毒剂,也是一种重要的冷冻介质。实验室可用如图所示装置制备SO2,并用纯净SO2进行相关实验。
(1)上述方法制备的SO2,往往因伴有硫酸小液滴而呈白雾状。除去白雾可在制备装置后连接除杂装置,请画出除杂装置并标明装置中的试剂___________。

(2)将SO2通入0.1mol/L Ba(NO3)2溶液得到白色沉淀,该反应的离子方程式为_______。
分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
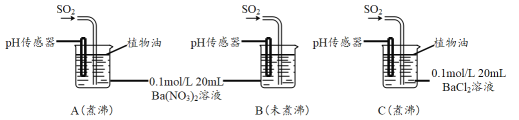
(3)实验C中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,用化学用语表示其原因______________________________。
(4)实验B中出现白色沉淀比实验A快很多。由此得出的结论是_________________。
(5)测定水中溶解O2的量,常用的方法是:
i.量取a mL水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子,振荡使反应均匀。
ii.开塞,迅速加入适量的硫酸,此时有I2生成。
iii.向ii所得溶液中滴加2滴淀粉溶液为指示剂,用b mol/LNa2S2O3标准溶液滴定至终点共消耗了Na2S2O3溶液V mL。
有关反应方程式为:2Mn2+ + O2+ 4OH- = 2MnO(OH)2(反应很快)
MnO(OH)2 + 2I- + 4H+= Mn2+ + I2 + 3H2O
I2 + 2S2O32- = 2I- + S4O62-
①水中溶解 O2的量(以mg/L为单位)为___________________。
②判断达到滴定终点的实验依据为 __________。
【答案】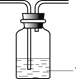 饱和NaHSO3 溶液 3Ba2+ + 3SO2 + 2NO3-+ 2H2O=3BaSO4↓ +2NO↑ +4H+ SO2 + H2O
饱和NaHSO3 溶液 3Ba2+ + 3SO2 + 2NO3-+ 2H2O=3BaSO4↓ +2NO↑ +4H+ SO2 + H2O ![]() H2SO3 H2SO3
H2SO3 H2SO3 ![]() H++ HSO3﹣ 在水溶液中O2氧化SO2 的速率比NO3﹣快
H++ HSO3﹣ 在水溶液中O2氧化SO2 的速率比NO3﹣快 ![]() 当滴定至溶液蓝色恰好褪去,且半分钟内不恢复蓝色
当滴定至溶液蓝色恰好褪去,且半分钟内不恢复蓝色
【解析】
根据二氧化硫的性质及实验目的分析解答;根据二氧化硫的还原性分析书写反应方程式;根据滴定原理及涉及的反应方程式分析解答。
(1)可用饱和亚硫酸氢钠除去二氧化硫中的酸雾,洗气时,气体从长导管进入,故答案为: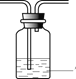 饱和NaHSO3 溶液;
饱和NaHSO3 溶液;
(2)SO2通入Ba(NO3)2溶液中,被氧化生成硫酸钡白色沉淀、NO和硝酸,该反应的离子方程式为3Ba2+ + 3SO2 + 2NO3-+ 2H2O=3BaSO4↓ +2NO↑ +4H+;
(3)二氧化硫与氯化钡不反应,所以没有沉淀生成,二氧化硫与水反应生成亚硫酸,亚硫酸溶液呈酸性,涉及反应为:SO2 + H2O ![]() H2SO3 H2SO3
H2SO3 H2SO3 ![]() H++ HSO3﹣;
H++ HSO3﹣;
(4)实验B中出现白色沉淀比实验A快很多,B中有氧气参与反应,则速率较快,生成更多的硫酸,pH较小,故答案为:在水溶液中O2 氧化SO2 的速率比NO3-快;
(5)根据滴定过程中发生的反应找出关系式:O2~2MnO(OH)2~2I2~4S2O32-,则n(O2)=![]() n(S2O32-)=
n(S2O32-)=![]() ×b mol/L×V×10-3L=
×b mol/L×V×10-3L=![]() mol,则水中溶解O2的量(以mg/L为单位)为
mol,则水中溶解O2的量(以mg/L为单位)为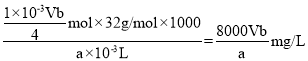 ,故答案为:
,故答案为:![]() ;
;
(6)当达到滴定终点时,I2完全反应,溶液蓝色恰好褪去,故答案为:当滴定至溶液蓝色恰好褪去,且半分钟内不恢复蓝色。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)元素④在周期表中位置是_______。元素③的最高价氧化物的化学式为________。
(2)元素①⑤组成化合物电子式为___________。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____(用离子符号表示)。
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。
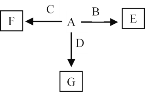
①A和F的化学式分别为_______、_______。
②B与G反应的化学方程式为____________________。
③C与NaOH溶液反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素,回答下列问题:
(1)Zn2+原子核外电子排布式为_______________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)______I1(Cu)填“大于”或“小于”)。原因是_______________________________。
(3)ZnF2具有较高的熔点(872℃),其化学键类型是______,ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是_____________________________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为______,C原子的杂化形式为___________________。

(5)金属Zn晶体中这种堆积方式称为_______________。该晶胞中含有的微粒个数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行硫酸铜晶体(![]() )结晶水含量的测定实验。完成下列填空:
)结晶水含量的测定实验。完成下列填空:
(实验步骤):
(1)在__________(填仪器名称)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入一定量的硫酸铜晶体,并称重。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至_______(填仪器名称)中冷却到室温,并称重。
(4)重复上述实验进行恒重操作,其目的是_______________,直到两次称量结果不超过______克。
(5)下面是该学生实验的一次数据,请完成计算:
坩埚质量(克) | 坩埚与晶体的质量(克) | 恒重后坩埚与固体质量 |
13.721 | 24.692 | 20.631 |
![]() ______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
(6)这次实验中产生误差的原因可能是_______
a. 硫酸铜晶体中含有不挥发性杂质 b. 在加热过程中发现有黑色物质生成
c. 加热时有晶体飞溅出来 d. 加热失水后露置在空气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以电石主要成分是CaC2)为原料制备乙炔,装置如图所示:
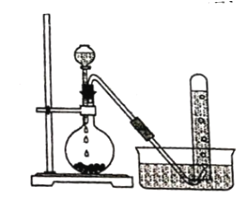
(1)实验室制取乙炔的化学方程式为 ______________。
(2)为除去乙炔中混有的少量硫化氢杂质,可将气体通过 ____________ (选填编号)。
a.酸性KMnO4溶液 b.CCl4 c.NaOH溶液
(3)氧炔焰是乙炔在氧气中燃烧的高温火焰,可用于______________________ 。
(4)乙炔在一定条件下三聚得到CH2=CHC≡CCH=CH2,写出与该三聚物具有相同化学式且不能使溴的CCl4溶液褪色和酸性高锰酸钾溶液褪色的物质的结构简式_________
(5)乙炔聚合得到聚乙炔,聚乙炔__________导电(选填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿克他利M(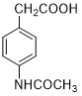 )是一种抗风湿性关节炎药物,其合成路线如下:
)是一种抗风湿性关节炎药物,其合成路线如下:
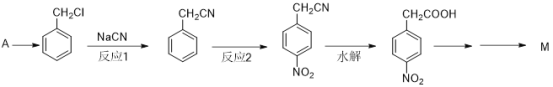
(1)反应1的类型为______________________________。
(2)反应2的试剂为______________________________。
(3)写出 的所有含苯环结构的同分异构体的结构简式______________。
的所有含苯环结构的同分异构体的结构简式______________。
(4)写出由对硝基苯乙酸( )得到对硝基苯乙酸乙酯的试剂和条件______。
)得到对硝基苯乙酸乙酯的试剂和条件______。
(5)A的分子式为C7H8,写出由A合成苯甲醛的合成路线。
(合成路线常用的表示方式为: )
)
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境治理依然是当今的热点问题。研究相关问题具有重要意义。回答下列问题:
(1)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g) 快 ΔH1<0
N2O2(g) 快 ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g) 慢 ΔH2<0
2NO2(g) 慢 ΔH2<0
反应2NO(g)+O2(g)![]() 2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
(2)工业上常利用CH4来吸收CO2生成CO和H2,再用H2和CO合成甲醇。如在恒容密闭容器中通入物质的量浓度均为1.0mol·L-1的CH4与CO2,在一定条件下仅发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
则:①该反应的ΔH___(填“<”“=”或“>”)0。
②压强p1、p2、p3、p4由大到小的关系为___。判断的理由是______。压强为p4时,在b点:v(正)___(填“<”“=”或“>”)v(逆)。

③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),当p4=0.36MPa,则a点的平衡常数Kp=___(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气中硫的回收反应为2CO(g)+SO2(g)=2CO2(g)+S(l)。在其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图2所示。260℃时,____ (填“La2O3”NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是__。
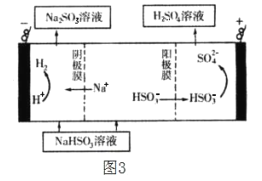
(4)该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图3,写出开始电解时阳极的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )

A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y是短周期元素,它们可组成化合物XY,则下列说法正确的是
A.XY晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m![]() 6
6
C.X、Y可以属于同一周期,也可居于两个不同周期
D.X与Y一定不属于同一主族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com