

分析 卤块(主要成分是MgCl2、此外还含有少量的Fe2+、Fe3+和Mn2+),加水后得溶液A中含有Mg2+、Fe2+、Fe3+和Mn2+,为除去Fe2+,先将Fe2+氧化成Fe3+,所以溶液B中含有Mg2+、Fe3+和Mn2+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,
(1)所得产品为MgO,其中所含非金属元素为氧元素;
(2)MgCO3加热煮沸可得到Mg(OH)2,根据元素守恒可知气体为二氧化碳;
(3)将溶液中的Fe2+氧化成Fe3+,需要加氧化剂且最好不能引入新杂质;
(4)B中含有Mg2+、Fe3+和Mn2+,据此判断沉淀物1中的成份;
(5)滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来;
(6)流程中根据元素守恒,由氧化镁可计算出原卤块中MgCl2的质量,根据质量分数=$\frac{MgCl2的质量}{样品的质量}$×100%计算.
解答 解:卤块(主要成分是MgCl2、此外还含有少量的Fe2+、Fe3+和Mn2+),加水后得溶液A中含有Mg2+、Fe2+、Fe3+和Mn2+,为除去Fe2+,先将Fe2+氧化成Fe3+,所以溶液B中含有Mg2+、Fe3+和Mn2+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,
(1)所得产品为MgO,其中所含非金属元素为氧元素,氧元素在周期表中的位置是第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)MgCO3加热煮沸可得到Mg(OH)2,根据元素守恒可知气体为二氧化碳,二氧化碳的结构式为O=C=O,
故答案为:O=C=O;
(3)将溶液中的Fe2+氧化成Fe3+,需要加氧化剂且最好不能引入新杂质,所以X最好选用H2O2+H2SO4(稀),
故答案为:A;
(4)B中含有Mg2+、Fe3+和Mn2+,所以沉淀物1中的成份为Mn(OH)2和Fe(OH)3 ,
故答案为:Fe(OH)3;
(5)滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,反应的离子方程式为Mg2++CO32-=MgCO3↓,
故答案为:Mg2++CO32-=MgCO3↓;
(6)流程中根据元素守恒,由氧化镁可计算出原卤块中MgCl2的质量为$\frac{4000}{40}×95$g=9.5kg,MgCl2的质量分数=$\frac{MgCl2的质量}{样品的质量}$×100%=$\frac{9.5}{m}$×100%=$\frac{950}{m}$%,
故答案为:$\frac{950}{m}$%.
点评 本题结合工业生产实际考查无机化合物的转化生成、分离、提纯等问题,题目与难度中等,在明确题目要求的基础上提取有用信息是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | K+、Mg2+、SO42-、Cl- | B. | K+、Na+、CO32-、OH- | ||
| C. | Ca2+、MnO4-、NO3-、Cl- | D. | Na+、Cu2+、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
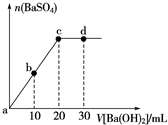
| A. | 溶液的pH:a<b<c<d | B. | 溶液的导电性:c<d | ||
| C. | a、b溶液呈酸性 | D. | c、d溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往澄清石灰水中通入过量的CO2:OH-+CO2═HCO3- | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 小苏打与醋酸反应:HCO3-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ⅱ表示的是滴定醋酸的曲线 | |
| B. | V(NaOH)=20ml时,${C_{(C{l^-})}}$=${C_{(C{H_3}CO{O^-})}}$ | |
| C. | PH=7时,滴定醋酸消耗V(NaOH)小于20ml | |
| D. | V(NaOH)=10ml时,醋酸溶液中:${C_{(N{a^+})}}$>${C_{(C{H_3}CO{O^-})}}$>${C_{({H^+})}}$>${C_{(O{H^-})}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com