
|
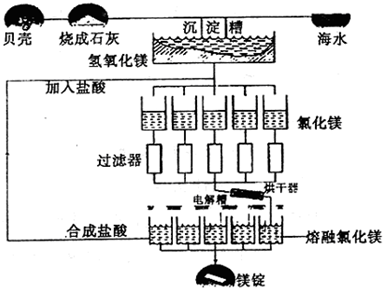
工业上制金属镁,采用电解熔融氯化镁而不电解熔融氧化镁是因为氧化镁比氯化镁 | |
| [ ] | |
A. |
熔点高很多 |
B. |
硬度大很多 |
C. |
难溶于水 |
D. |
稳定 |
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
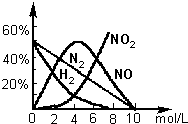 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的.
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:四川省模拟题 题型:填空题
 CH3OH(g);△H=-90.7 kJ/mol;
CH3OH(g);△H=-90.7 kJ/mol;  CH3OCH3(g) +H2O(g);△H= -23.5 kJ/mol;
CH3OCH3(g) +H2O(g);△H= -23.5 kJ/mol;  CO2(g)+H2(g);△H=-41.2kJ/mol。
CO2(g)+H2(g);△H=-41.2kJ/mol。 CH3OCH3(g) +CO2(g),则该反应的△H=____________
CH3OCH3(g) +CO2(g),则该反应的△H=____________  CH3OCH3(g) +3H2O(g);
CH3OCH3(g) +3H2O(g);
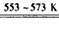 SiHCl3(l)+ H2(g);
SiHCl3(l)+ H2(g); Si(纯) +3HCl。
Si(纯) +3HCl。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com