
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:

注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是_____,主要作用是________。三颈瓶中发生反应的化学方程式为_______。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_________。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过__________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000 mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_______(保留一位小数)。下列情况会使测定结果偏低的是____(填字母)。
a.滴定终了俯视读取数据 b.KOH标准液长时间接触空气
c.配制KOH标准液时仰视定容 d.将指示剂换为甲基橙溶液
【答案】球形冷凝管 冷凝回流,防止甲苯的挥发而降低产品产率 ![]() +2H2O2
+2H2O2![]() +3H2O H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少影响产量 过滤 蒸馏 dacb 87.8﹪ ad
+3H2O H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少影响产量 过滤 蒸馏 dacb 87.8﹪ ad
【解析】
(1)由仪器a结构可知为球形冷凝管,甲苯挥发会导致产率降低;三颈瓶中甲苯被过氧化氢氧化生成苯甲醛,同时还生成水;
(2)根据温度过高时过氧化氢分解分析解答;
(3)反应完毕后,反应混合液经过自然冷却至室温时,先过滤分离固体催化剂,再利用蒸馏的方法分离出苯甲酸;
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸;
①先与碳酸氢钠反应之后为苯甲酸钠,再分液分离,水层中加入盐酸得到苯甲酸晶体,最后过滤分离得到苯甲酸;
②苯甲酸的物质的量等于消耗KOH物质的量,再计算产品中苯甲酸的质量分数;
a.滴定时俯视读取耗碱量,会使KOH溶液体积读数偏小;
b.KOH标准液长时间接触空气,会吸收二氧化碳步骤转化为碳酸钾,导致消耗氢氧化钾溶液体积偏大;
c.配置KOH标准液时仰视定容,液面在刻度线上方,配制标准液的体积偏大、浓度偏小,导致滴定时消耗KOH溶液体积偏大;
d.将酚酞指示剂换为甲基橙溶液,终点时溶液呈酸性,消耗氢氧化钾溶液体积偏小。
(1)由仪器a结构可知为球形冷凝管,甲苯挥发会导致产率降低,冷凝回流,防止甲苯挥发导致产率降低;三颈瓶中甲苯被过氧化氢氧化生成苯甲醛,同时还生成水,反应方程式为:![]() ;
;
(2)温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,苯甲醛的产量却有所减少;
(3)反应完毕后,反应混合液经过自然冷却至室温时,先过滤分离固体催化剂,再利用蒸馏的方法分离出苯甲酸;
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸;
①先与碳酸氢钠反应之后为苯甲酸钠,再分液分离,水层中加入盐酸得到苯甲酸晶体,最后过滤分离得到苯甲酸,再洗涤、干燥得到苯甲酸,故正确的操作步骤是:dacb,故答案为:dacb;
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mo/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL;苯甲酸的物质的量等于消耗KOH物质的量,则2.500g产品中苯甲酸为0.018L×0.1mol/L×![]() ×122g/mol=2.196g,产品中苯甲酸的质量分数为
×122g/mol=2.196g,产品中苯甲酸的质量分数为![]() ×100%=87.8%;
×100%=87.8%;
a.滴定时俯视读取耗碱量,会使KOH溶液体积读数偏小,计算苯甲酸的质量偏小,测定结果偏低,故a正确;
b.KOH标准液长时间接触空气,会吸收二氧化碳步骤转化为碳酸钾,导致消耗氢氧化钾溶液体积偏大,测定结果偏高,故b错误;
c.配置KOH标准液时仰视定容,液面在刻度线上方,配制标准液的体积偏大、浓度偏小,导致滴定时消耗KOH溶液体积偏大,测定结果偏高,故c错误;
d.将酚酞指示剂换为甲基橙溶液,终点时溶液呈酸性,消耗氢氧化钾溶液体积偏小,测定结果偏低,故d正确;
故答案为ad。


科目:高中化学 来源: 题型:
【题目】如图所示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。

请填写下列空白:
(1)写出化学式:
A___________、B__________、C ___________、D __________。
(2)以上反应中属于氧化还原反应的有_________________。(填写编号)
(3)写出A→C反应的离子方程式____________________________________________;E→D的化学方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,使26 g CO和O2的混合气体充分反应,所得混合物在常温下与足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中CO和O2的质量比可能是____________。
(2)某同学在一次实验中发现:将新制氯水逐滴加到含有酚酞的NaOH溶液中,当加到最后一滴时溶液的红色突然消失。
该同学对“溶液的红色突然消失”的原因进行了探究:
①猜测:a.氯水中的盐酸中和了NaOH,使酚酞由红色变为无色;
b._____________。
②请设计一个实验方案验证上述猜测:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2和N2O4的相互转化2NO2(g)![]() N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
Ⅰ. 将N2O4 (g)转化为N2O4(l),可用来制备硝酸。
(1)已知2NO2(g)![]() N2O4(g) △H1 2NO2(g)
N2O4(g) △H1 2NO2(g)![]() N2O4(l) △H2
N2O4(l) △H2
下列能量变化示意图正确的是____________。
A. 
B. 
C. 
(2)NO2和N2O4物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为_____。
Ⅱ. 对于2NO2(g)![]() N2O4(g)反应体系,标准平衡常数Kθ=
N2O4(g)反应体系,标准平衡常数Kθ= ,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
(1)若起始NO2的物质的量设为1mol,反应在恒定温度和标准压强下进行,N2O4的平衡产率为0.75,则Kθ=____________。
(2)利用现代手持技术传感器可以探究压强对2NO2 (g) ![]() N2O4 (g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
N2O4 (g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①B点时NO2的转化率为____________。
②E、H两点对应气体的平均相对分子质量ME __________MH(填“<、>或=”)。
Ⅲ. 已知反应:2NO(g)+O2(g)![]() 2NO2(g)是通过下面两步完成的:
2NO2(g)是通过下面两步完成的:
反应①:2NO(g)![]() N2O2(g) △H1<0(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g) △H1<0(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
反应②:N2O2(g)+O2(g)![]() 2NO2(g) △H2<0(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g) △H2<0(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
某科研小组测量出反应②的部分实验数据如下表所示:
c(N2O2)/ mol/L | c(O2)/ mol/L | ν2正/ mol·L-1·s-1 |
0.010 | 0.010 | 1.75×10-6 |
0.030 | 0.020 | 1.05×10-5 |
x | 0.060 | 1.05×10-5 |
(1)根据上表中的有关数据计算:x=________。
(2)若①、②两反应的正、逆反应速率常数分别用k1正、k2逆、k2正、k2逆表示,则2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=____(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化趋势是逐渐_____。
2NO2(g)的平衡常数K=____(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化趋势是逐渐_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:

请回答下列问题:
(1)已知25℃时,Cu (OH)2的Ksp=4.0×10-20调节溶液pH到4.0时,溶液C中Cu2+的最大浓度为____________mol·L1。
(2)在整个实验过程中,下列实验装置不可能用到的是________(填序号)。

(3)溶液A中所含溶质为__________________________;物质X应选用________(填序号)。
A.氯水 B.双氧水 C.铁粉 D.高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为______________________________。
(5)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
滴定次数 | 第一次 | 第二次 | 第三次 |
滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI反应的离子方程式为______________________________。
②滴定终点的现象是____________________________________________________________。
③溶液A中c(Cu2+)=________mol·L-1。
(6)利用氧化铜和无水硫酸铜按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体且该液体有刺激性气味,则X气体是___________(填序号),写出其在a处所发生的化学反应方程式___________________________________________。

A.H2
B.CH3CH2OH(气)
C.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下列说法不正确的是

A. 最高价氧化物对应水化物的酸性:Z>Y
B. W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
C. 在元素周期表中,117号元素与Z元素位于同一主族
D. 工业上常用YX2漂白纸浆、毛、丝等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属冶炼的反应原理,错误的是( )
A. 高炉炼铁:Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
B. 火法炼铜:Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
C. 铝的冶炼:Al2O3+3H2![]() 2Al+3H2O
2Al+3H2O
D. 铝热法炼铁:Fe2O3+2Al![]() 2Fe +Al2O3
2Fe +Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol BaSO4粉末置于盛有500 mL蒸馏水的烧杯中,然后烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
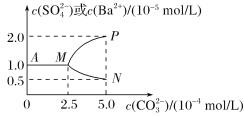
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
D. 若使0.1 mol BaSO4全部转化为BaCO3,至少要加入2.6 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁——次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含![]() 的工业废水的处理。下列说法正确的是( )
的工业废水的处理。下列说法正确的是( )

A. 图乙中![]() 向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
C. 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生
D. 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com