
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。
回答下列问题:
(1)b、c、d电负性最大的是___(填元素符号)。
(2)b单质分子中σ键与π键的个数比为___。
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为___;这两种物质的互溶物中,存在的化学键有___(填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是___(填化学式,下同);酸根呈正三角形结构的酸是___,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子___酸根离子(填“>”或“<”)。
(5)元素e在周期表中的位置是___区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为![]() ,请补写e的元素符号并用“→”表示出其中的配位键___。
,请补写e的元素符号并用“→”表示出其中的配位键___。
【答案】O 1:2 sp3 ①② H2SO4、H2SO3 HNO3 < d 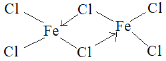
【解析】
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,a为H,基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态即2p3,则b为N,c的最外层电子数是内层电子数的3倍,则c为O,d的原子序数是c的两倍,d为S,基态e原子3d轨道上有4个单电子,则为3d6,即e为Fe。
A:H,b:N,c:O,d:S,e:Fe。
⑴电负性从左到右依次递增,从上到下依次递减,b、c、d电负性最大的是O,故答案为:O。
⑵b单质分子为氮气,氮气中σ键与π键的个数比为1:2,故答案为:1:2。
⑶a与c可形成两种二元化合物分子,分别为水和过氧化氢,过氧化氢不稳定,过氧化氢的结构式为H—O—O—H,每个氧原子有2个σ键,还有2对孤对电子,因此O原子的杂化方式为sp3,水和过氧化氢互溶物中,水中有共价键,过氧化氢中有极性共价键,非极性共价键,分子之间有范德华力和分子间氢键,但范德华力和分子间氢键不是化学键,因此存在的化学键有①②,故答案为:sp3;①②。
⑷这些元素形成的含氧酸中,有硝酸、亚硝酸、硫酸、亚硫酸,硝酸分子N有3个σ键,孤对电子为0,因此价层电子对数为3,硝酸根价层电子对数为3+0=3,为正三角形;亚硝酸分子N有2个σ键,孤对电子为1,因此价层电子对数为3,亚硝酸根价层电子对数为2+1=3,为“V”形结构;硫酸分子S有4个σ键,孤对电子为0,因此价层电子对数为4,硫酸根价层电子对数为4+0=4,为正四面体结构;亚硫酸分子S有3个σ键,孤对电子为1,因此价层电子对数为4,亚硫酸根价层电子对数为3+1=4,为三角锥形结构,因此分子内中心原子的价层电子对数为4的酸是H2SO4、H2SO3,酸根呈正三角形结构的酸是HNO3;酸分子中心原子带正电荷,吸引氧原子上的电子,使得氧与氢结合形成的电子对易断裂,因此酸分子稳定性 < 酸根离子稳定性,故答案为:H2SO4、H2SO3;HNO3;<。
⑸元素e的价电子为3d64s2,在周期表中的位置是d区,e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,中间的Cl与其中易个Fe形成共价键,与另一个Fe形成配位键,Cl提供孤对电子,因此其结构式为 ,故答案为:d;
,故答案为:d; 。
。


科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
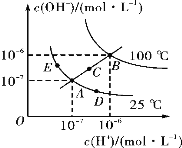
A.图中三点对应水电离出氢离子浓度关系:E<A<D
B.若从A点到E点,可采用温度不变,向水中加入适量的NaAc固体
C.图中三点对应离子积关系:B>C>A
D.当处在B点时,将pH=3的硫酸与pH=11的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10—10),下列说法正确的是
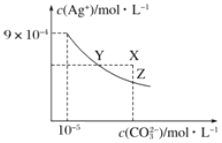
A.根据图示可计算出Ksp(Ag2CO3)=9×10—9
B.向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点
C.反应Ag2CO3(s)+2Cl—(aq)![]() 2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
D.将0.001mol/LAgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CO3的混合溶液,CO32—先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:

(1)①用离子方程式表示实验I溶液变红的原因___。
②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如图实验装置证实了猜想是成立的。

其中X溶液是___,检验产物SO42-的操作及现象是___。
(2)针对实验II“红色明显变浅”,实验小组提出预测。
原因①:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
原因②:SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-![]() [Fe(SCN)]2+平衡左移,红色明显变浅。
[Fe(SCN)]2+平衡左移,红色明显变浅。
已知:Mg2+与SCN-难络合,于是小组设计了如下实验:
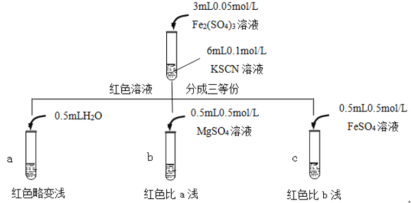
由此推测,实验II“红色明显变浅”的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是( )

A. 曲线A表示NaOH溶液中滴加稀盐酸
B. 曲线B表示CH3COOH溶液中滴加KOH溶液
C. 曲线C表示Ba(OH)2溶液中滴加稀硫酸
D. 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.除去苯中的杂质苯酚可加入浓溴水后过滤
B.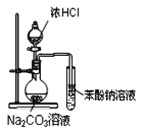 装置可证明酸性:盐酸>碳酸>苯酚
装置可证明酸性:盐酸>碳酸>苯酚
C.乙二酸与足量的酸性KMnO4溶液混合:5H2C2O4 + 2MnO4- + 6H+ =10CO2 ↑ + 2Mn2+ + 8H2O
D.鉴别![]() 和
和![]() 只能用金属钠
只能用金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
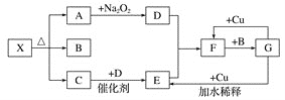
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com