
【题目】下列正确的是( )
A.碳酸的电离:H2CO3?H++HCO ![]()
B.硫化钠水解:S2﹣+2H2O?H2S↑+2OH﹣
C.Na2CO3溶液中:c(HCO ![]() )>c(OH﹣)
)>c(OH﹣)
D.NH4Cl溶液中,c(NH ![]() )>c(Cl﹣)
)>c(Cl﹣)
【答案】A
【解析】解:A.碳酸为二元弱酸,分步电离,电离方程式为:H2CO3H++HCO ![]() ,HCO
,HCO ![]() H++CO
H++CO ![]() ,以第一步为主,故A正确; B.硫离子是多元弱酸阴离子分步水解,水解程度微弱,不能生成硫化氢气体,水解的离子方程式为:S2﹣+H2OHS﹣+OH﹣ , HS﹣+H2OH2S+OH﹣ , 故B错误;
,以第一步为主,故A正确; B.硫离子是多元弱酸阴离子分步水解,水解程度微弱,不能生成硫化氢气体,水解的离子方程式为:S2﹣+H2OHS﹣+OH﹣ , HS﹣+H2OH2S+OH﹣ , 故B错误;
C.由于盐类的水解程度很小,故离子浓度大小关系为:c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO ![]() )>c(H+),故C错误;
)>c(H+),故C错误;
D.氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2ONH3 . H2O+H+ , 所以c(H+)>c(OH﹣),铵根离子水解、钠离子不水解,所以c(Cl﹣)>c(NH4+),故D错误;
故选A.


科目:高中化学 来源: 题型:
【题目】通过实验来验证淀粉水解可生成葡萄糖,其实验包括下列操作过程,这些操作过程的正确排列顺序是( )
①取少量淀粉和水制成溶液 ②加热煮沸 ③加入碱液中和酸性 ④加入新制Cu(OH)2碱性悬浊液 ⑤加入少量稀硫酸 ⑥再加热
A.①②⑤⑥④③B.①⑤②④⑥③
C.①⑤②③④⑥D.①⑥④⑤③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的锌粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaNO3 (溶液)
B.CH3COONa(固体)
C.Na2CO3(溶液)
D.CuSO4 (固体)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】营养强化剂是为了食物的营养价值而强制添加的物质,比如食盐中加碘,是为了预防碘缺乏病的发生。食盐中加碘,所加“碘”指的是( )
A.碘单质B.碘酸钾
C.碘化钾D.次碘酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含FeCl2杂质的氯化铜晶体(CuCl22H2O),为制取纯净的CuCl22H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯: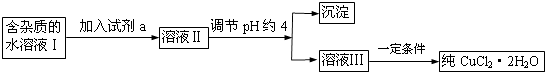
25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 4.7 |
完成沉淀pH | 3.2 | 9.7 | 6.7 |
请回答下列问题:
(1)流程中加入的试剂a最合适的是(填序号)A.酸性高锰酸钾溶液 B.NaClO溶液C.H2O2溶液 D.稀硝酸
加入试剂a的目的是 .
(2)调节pH约4应该加入的物质可以是 .
A.CuO
B.CuCl2
C.Cu(OH)2
D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl22H2O?(填“能”或“不能”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. ρ=(17V+22 400)/(22.4+22.4V)
B. ω=17c/(1 000ρ)
C. ω=17V/(17V+22 400)
D. c=1 000Vρ/(17V+22 400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,每年由于腐蚀而直接损耗的金属材料约占金属年产量的10%.下列措施中,不能防止金属腐蚀的是( )
A.在金属表面涂一层油漆
B.在金属表面涂机油
C.在金属表面涂食盐溶液
D.在金属表面镀一层不活泼金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1) 利用黄铜矿冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
① 反应中被还原的元素是________(填元素符号),
② 生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:①用过量稀盐酸浸取炉渣,过滤。②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
① 所选试剂为___________________
② 证明炉渣中含有FeO的实验现象为_____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com