
【题目】苯分子中不存在C—C键和C=C键交替结构,下列事实不能说明的是
A.苯不能使酸性高锰酸钾溶液褪色
B.苯分子中碳碳键的键长都相等
C.苯在加热和催化剂存在条件下与氢气反应生成环己烷
D.苯能与液溴发生取代反应,但不能与溴水发生加成反应
科目:高中化学 来源: 题型:
【题目】SiCl4是一种常见的烟雾剂,已知SiCl4的沸点为57.6℃,易挥发和水解。实验室用硅粉与氯气反应制备SiCl4的装置如图所示(夹持装置略去)。
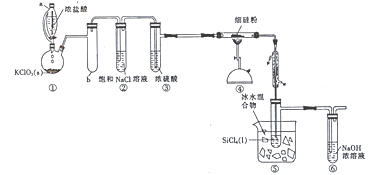
回答下列问题:
(1)装置①中用仪器a代替分液漏斗,其优点是__________________;连接的具支试管b的作用是_____________;氯酸钾与浓盐酸反应的化学方程式为______________________。
(2)实验开始时,先滴入浓盐酸,一段时间后再点燃④中的酒精喷灯,其目的是_____________。
(3)装置⑤的烧杯中用冰水混合物的作用是____________________ 。
(4)某同学认为整套装置中有不足之处,在实验中装置⑤的试管中可能会出现白雾,其原因是______________________ (用化学方程式表示)。请你提出改进的措施:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示,

判断下列叙述中正确的是
A. 每生成2分子AB吸收bkJ热量
B. 该反应热△H=+(a-b)kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1molA—A和1molB—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O2NH3+ ![]() O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
T/℃ | 30 | 40 | 50 |
生成NH3量/(10﹣6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为molh﹣1 .
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是 . 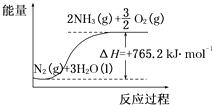
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议: .
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 在某压强恒定的密闭容器中加入2mol N2和4mol H2 , 达到平衡时,N2的转化率为50%,体积变为10L.求: ①该条件下的平衡常数为;
②若向该容器中加入a mol N2、b mol H2、c mol NH3 , 且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量(填“>”“<”或“=”)92.4kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
①该电池的负极材料是______________。电池工作时,电子流向______________(填“正极”或“负极”)。
②若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是______________。欲除去Cu2+,最好选用下列试剂中的______________(填字母序号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(2)给你提供纯锌片、纯铜片和500mL0.2mol·L-1的H2SO4溶液、导线、1000mL量筒。试用右图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
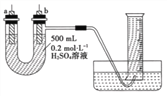
①装置气密性良好,且1000mL量筒中已充满了水,则开始实验时,首先要______________。
②a电极材料为______________,其电极反应式为______________;b电极材料为______________,其电极反应式为______________。
③当量筒中收集672mL气体时(已折算成标准状况下),通过导线的电子的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热5.00 g的碳酸钠和碳酸氢钠的混合物至反应完全,混合物质量减少了0.31 g,则原混合物中碳酸钠的质量为
A. 3.38 g B. 4.16 g C. 4.58 g D. 4.41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089 nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径 (nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | 2 | 3 | 1 | 3 |
(1)⑧号元素的在周期表中的位置是________________;上述元素处于同一主族的有_________________________。(用元素符号表示!)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为8电子的稳定结构,写出其电子式:__________________________(任写一种
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_____________________________________________________。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是________
用作高温堆减速剂。下列说法正确的是________
A. ![]() 和
和![]() 互为同位素 B.
互为同位素 B. ![]() 和
和![]() 属于同种核素
属于同种核素
C. ![]() 和
和![]() 的化学性质不同 D.
的化学性质不同 D. ![]() 和
和![]() 是同种物质
是同种物质
②下列说法不正确的是_________
A. 碱性:Be(OH)2 < LiOH < NaOH < KOH
B. 半径:K > Na > Li > Li+
C. 氧化性:Li+ < Na+ < K+ < Rb+ < Cs+
D. 金属性:Cs > Rb > K > Na > Li > Be
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com