
【题目】氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、Cl2反应合成氯化亚砜。发生如下反应:
①Cl2(g)+SO2(g)![]() SO2Cl2(g) △H =-471.7kJmol-1
SO2Cl2(g) △H =-471.7kJmol-1
②SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H=-5.6kJmol-1
2SOCl2(g) △H=-5.6kJmol-1
567K时,在10L密闭容器中,充入一定量的Cl2、SO2和SCl2,测得初始压强为P0反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示,起始各组分及达平衡时SO2Cl2(g)的物质的量如表。

各组分 | Cl2 | SO2(g) | SCl2(g) | SO2Cl2(g) | SOCl2(g) |
起始/mol | 0.5 | 0.5 | 0.5 | 0 | 0 |
平衡/mol | 0.2 |
(1)图中数据显示0~l min体系压强增大的原因是____。
(2)反应①、②达到平衡时,SCl2的转化率为__。
(3)pK=-lgK,567K时,上述反应②的pK=___(结果保留两位有效数字,已知lg2=0.30)。
(4)567K下,若压缩容器体积为5L,则平衡时c(SO2)__(填“大于” “小于”或“等于”)上述反应平衡时的c(SO2)。
II.氯化亚砜常用于合成正丁酰氯。向连有尾气吸收装置的容器中按照物质的量1:1.5投料比加入正丁酸和氯化亚砜,反应为CH3CH2CH2COOH+SOCl2![]() CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
序号 | 实验方法 | 收率/% |
1 | 25℃,反应6h | 73.60 |
2 | 25℃,反应8h | 74.60 |
3 | 75℃,反应2h | 75.00 |
4 | 75℃,反应3h | 76.00 |
5 | 先25℃,反应1h;后75℃,反应0~1h | 81.10 |
6 | 先25℃,反应1h;后75℃,反应0~1h | 87.10 |
(5)若开始在较高温度下反应,则会放出大量气体。通过分析上表数据,选择合理实验方法的序号为___。说明你选用实验方法的理由:____。
【答案】反应为放热反应,温度升高使体系压强增大 20% 0.30 大于 6 既避免了开始因反应较快而发生原料冲 出反应容器的危险,又使得反应最终有较高的收率
【解析】
I.(1)由已知条件热化学方程式可知,反应放热,使体系内气体运动加快,体积膨胀,从而使体系压强增大。
答案为:反应为放热反应,温度升高使体系压强增大;
(2)根据反应②SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H=-5.6kJmol-1和表格数据,平衡时生成SO2Cl20.2mol,消耗SCl2为0.1mol,因此,SCl2转化率=
2SOCl2(g) △H=-5.6kJmol-1和表格数据,平衡时生成SO2Cl20.2mol,消耗SCl2为0.1mol,因此,SCl2转化率=![]() =20%;
=20%;
答案为:20%;
(3)设平衡时,SO2Cl2的物质的量为xmol,根据化学反应:
Cl2(g)+SO2(g)![]() SO2Cl2(g) SO2Cl2(g)+SCl2(g)
SO2Cl2(g) SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g)
2SOCl2(g)
初始(mol) 0.5 0.5 0 x+0.1 0.5 0
变化(mol)x+0.1 x+0.1 x+0.1 0.1 0.1 0.2
平衡(mol)0.4-x 0.4-x x+0.1 x 0.4 0.2
由压强图象,4分钟后反应达到平衡状态,平衡时的压强为起始压强的0.8倍。
则![]() ,x=0.2
,x=0.2
反应②的平衡常数K=![]() =
=![]() ,pK=-lgK=-lg
,pK=-lgK=-lg![]() =-(lg1- lg2)= lg2- lg1=0.30;
=-(lg1- lg2)= lg2- lg1=0.30;
答案为:0.30
(4)外界条件的影响大于平衡体系内的变化,567K下,若压缩容器体积为5L,体系中各组分的浓度会增大,此时c(SO2)大于上述反应平衡时的c(SO2);
答案为:大于;
II. (5)根据表格数据,一方面题中信息已说明,刚开始在较高温度下反应,则会放出大量气体,会出现产生的气体将原料冲出反应容器的危险,另一方面第6组收率最高;
答案为:6;既避免了开始因反应较快而发生原料冲出反应容器的危险,又使得反应最终有较高的收率;


科目:高中化学 来源: 题型:
【题目】写出如图中序号①~④仪器的名称:
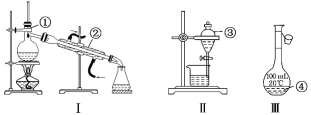
(1)①_____;②____;③_____;④_____。
(2)仪器①~④中,使用时必须检查是否漏水的有____(填仪器序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
B. 1LpH =1的H2SO4溶液中所含的H+数目为0.2NA
C. 标准状况下,22.4L的辛烷完全燃烧生成的CO2分子数为8NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×109NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含结晶水的碱式盐X(四种元素组成的纯净物)进行了如下实验:
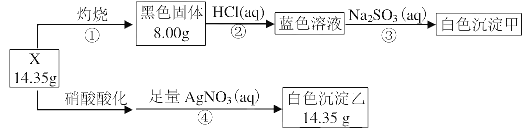
白色沉淀甲的组成元素与蓝色溶液的溶质相同,且组成的元素原子物质的量之比为1:1。请回答:
(1)X中含有的元素除了H、O之外,还含有的元素是___、____。
(2)白色沉淀甲的化学式是___,X的化学式是___。
(3)步骤③的离子方程式是___。
(4)在一定的温度下,将空气不断通入白色沉淀甲的悬浊液中可得到X,该反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及含磷化合物是重要的化工原料,广泛应用于洗涤剂、农药、医药、水处理等行业回答下列问题:
(1)基态P原子的轨道表示式为 ___(填字母)。
a.[Ne]![]() b.[Ne]
b.[Ne]![]()
c.[Ne]![]() d.[Ne]
d.[Ne]![]()
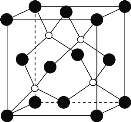
(2)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:
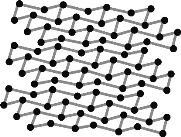
其中最小的环为___元环,每个环平均含有___个P原子。
(3)杀虫剂敌敌畏是有机磷化合物,其结构简式如图所示,其中C原子的杂化方式为____,甲基得一个电子后为CH3-,其空间构型为_____。
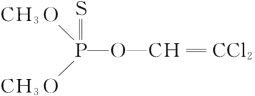
(4)磷化硼(BP)是一种超硬耐磨涂层材料,晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中。
①PH3、NH3、BP三种物质的熔沸点由大到小的顺序为_____。
②磷化硼晶胞结构如图所示,晶胞参数a=b=c=478pm,α=β=γ=90°,则磷化硼的密度是___g·cm-3。(列出计算表达式,设阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述错误的是( )
A. 生成的乙酸乙酯中含有18O
B. 生成的水分子中不含有18O
C. 可能生成88 g乙酸乙酯
D. 可能生成90 g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 , 。
(3)物质B可以被直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
① ;反应类型: 。
④ ;反应类型: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④该反应中CuO作为氧化剂参与反应
(3) 配平反应:____H2S+___SO2=____S+____H2O。
其中,氧化产物为________,还原剂为________,氧化剂为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备溴乙烷的装置(已知溴乙烷的沸点38.4℃)。步骤如下:
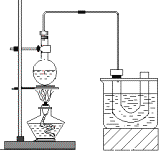
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇(密度为0.789g/cm3)、28mL78%浓硫酸,然后加入研细的23g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
已知:NaBr+H2SO4=HBr+NaHSO4
请回答下列问题:
(1)写出烧瓶中制备溴乙烷的化学方程式___________________________________。
(2)在大烧杯加入冰水的作用是____________________________________。溴乙烷的水溶性小于乙醇的水溶性,其原因是_________________________。反应一段时间后,U型管内可观察到的现象是___________________________。
(3)反应时若温度过高会有副反应发生,写出发生有机副反应的化学方程式________。(任写一个)
(4)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质,最好选择下列试剂中的__________(填序号)
A.H2O B.CCl4 C.Na2SO3溶液 D.NaOH溶液
除杂所需的主要玻璃仪器是__________________(填仪器名称)。要进一步制得纯净的溴乙烷,可再用水洗,然后加入无水CaCl2,再进行_________________(填操作名称)。
(5)最后制得溴乙烷产品14.2g,求上述实验中溴乙烷的产率为____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com