
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
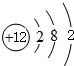 ;
;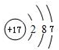 ,
,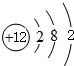 ;
; ;
; ,
, .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某原电池装置如图所示.下列有关叙述正确的是( )
某原电池装置如图所示.下列有关叙述正确的是( )| A、Cu为正极,发生氧化反应 |
| B、负极反应式为:2H++2e-=H2↑ |
| C、工作一段时间后,烧杯中溶液pH不变 |
| D、电池工作时,SO42-向Zn电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和溴单质反应:CH2═CH2+Br2→CH2-CH2Br2 | |||
B、合成聚乙烯塑料:nCH2═CH2→ | |||
C、皂化反应: +3H2O +3H2O
 +3C17H35COOH +3C17H35COOH | |||
| D、乙醇与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用烧碱已部分潮解 |
| B、氢氧化钠溶解后未冷却至室温就立即转移入容量瓶并定容 |
| C、定容后,溶液液面最高点与刻度线处在同一水平面上 |
| D、盛装氢氧化钠溶液的滴定管没有润洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com